Автор: ГалинаРаздел: Анализ микроструктуры материалов
Автор: ГалинаРаздел: Анализ микроструктуры материалов
Автор: Раздел: Атомно-силовая микроскопия
Автор: ГалинаРаздел: Анализ микроструктуры материалов
Автор: ВикторРаздел: Атомно-силовая микроскопия
Автор: ВикторРаздел: Атомно-силовая микроскопия
Автор: ВикторРаздел: Атомно-силовая микроскопия
Автор: ГалинаРаздел: Анализ микроструктуры материалов
Автор: ГалинаРаздел: Анализ микроструктуры материалов
Автор: ВикторРаздел: Анализ микроструктуры материалов
Нажимая кнопку «Подписаться», вы принимаете условия «Соглашения на обработку персональных данных».
Исследование топографии различных органических объектов в жидких растворах с помощью технологии SICM на АСМ NX10

Иногда, для того, чтобы определить и понять главную проблему, а затем разработать метод ее решения, необходимо исследовать объект в естественных условиях. Некоторые современные технологии и применения часто сталкиваются с подобными задачами. Среди них анализ отказов электродов батареек и аккумуляторов; изучение переноса ионов между клетками; изучение статических и динамических процессов внутри клетки и т.п.
Вышеописанные исследования объединяет то, что их необходимо проводить в естественных условиях (in situ) в жидких средах и электролитах, чтобы подробно изучить свойства материалов. Ранее для получения изображений из жидких сред использовались такие технологии, как атомно-силовая микроскопия. Но данное решение не может рассматриваться как идеальное, так как органические образцы в большинстве своем имеют тенденцию к смягчению и разбуханию при помещении их в жидкость, что увеличивает вероятность их повреждения самим кантилевером. Кроме того, даже слабое движение кантилевера может привести к колебанию образца или изменению его положения во время сканирования.
Поэтому, в такой ситуации требуется искать альтернативное решение проблемы. К счастью, такое решение было найдено довольно быстро с изобретением сканирующей ион-проводящей микроскопии (SICM) и ее внедрением в атомно-силовой микроскоп компании Park Systems: NX10 SICM. При исследовании методом SICM топографическое изображение образца получают за счет регулирования ионного тока, протекающего через нанопипетку на поверхность образца, который находится в электролите. Данный метод является полностью неинвазивным, поскольку не оказывает никакого физического давления на поверхность образца. Это позволяет преодолеть трудности, возникающие при сканировании органических образцов с помощью стандартной АСМ.
Эксперимент
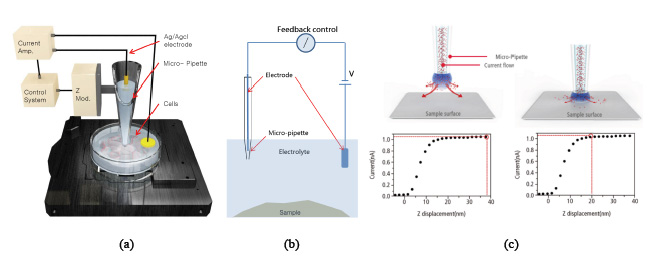
В данной статье описывается использование дополнительной модификации SICM для анализа органических образцов с помощью атомно-силового микроскопа NX10. Микроскоп, по сути, остается без каких-либо существенных изменений в архитектуре: только стандартная АСМ-головка заменяется на SICM-головку. Таким образом, вместо обычного игловидного кантилевера используется стеклянная или кварцевая нанопипетка (внутренний диаметр 80-100 нм или 30-50 нм соответственно), заполненная электролитом.
Данная нанопипетка подключается к Ag/AgCl электроду, а второй электрод опускается в раствор электролита, в котором находится образец (см. рис. 1а). В результате образуется замкнутая цепь, в которой к двум электродам прикладывается напряжение смещения и ионный ток протекает через нанопипетку к образцу (см. рис. 1б). Когда нанопипетка начинает приближаться к поверхности образца, значение ионного тока уменьшается и зависимость «ток-расстояние» регистрируется быстрым и точным механизмом обратной связи (см. рис. 1в). Когда пипетка практически касается поверхности образца, значение тока падает почти до нуля.
Степень снижения значения ионного тока используется для построения топографического изображения. Изначально сканирование производится при определенном установленном значении ионного тока. Это означает, что нанопипетка всегда находится над поверхностью образца на расстоянии порядка нескольких сотен нанометров, поскольку постоянным поддерживается и значение ионного тока за счет механизма обратной связи.
По аналогии со сканирующей туннельной микроскопией (STM), в которой для анализа поверхности материала регистрируется туннельный ток, SICM непрерывно регистрирует изменение ионного тока не только для поддержания бесконтактного режима сканирования, но также и для того, что не оказывать на поверхность образца силового воздействия.
К тому же, данный метод не использует кантилевер, который только вносит дополнительные трудности при сканировании органических образцов в жидких средах. Данная технология позволяет не только получать изображения очень высокого качества, но также делает возможным исследование особо мягких и чувствительных биологических материалов, таких как живые клетки, в наномасштабах.
Рис. 1. Схема экспериментальной установки и процесса измерения.
Существует два режима измерений методом SICM. Первый режим называется «сканирование подвод-отвод» (ARS). Данный режим широко используется при анализе образцов, которые имеют структуру поверхности с перепадами высот более 1 мкм, поскольку из-за сильного перепада высот нанопипетка может сломаться при выполнении непрерывного сканирования. Поэтому в режиме ARS нанопипетка приближается к поверхности образца до тех пор, пока значение ионного тока не опуститься до установленного граничного значения, а затем возвращается в исходное безопасное положение и только потом перемещается в следующую для сканирования точку. Данный цикл подвода-отвода повторяется для каждой точки сканирования (для каждого пикселя) до тех пор, пока не будет отсканирована вся заданная область.
Второй режим называется «сканирование прямым током» (DC). Данный режим широко используется при анализе образцов, которые имеют структуру поверхности с перепадами высот порядка нескольких сотен нм. Нанопипетка перемещается вдоль поверхности образца в непрерывном режиме, а за счет механизма обратной связи значение установленного порога ионного тока, а, следовательно, и расстояния до поверхности образца, остается неизменным.
Для того чтобы продемонстрировать простоту использования и точность метода SICM было исследовано три органических образца: полидиметилсилоксан (PDMS), поликарбонатная мембрана с диаметром пор 400 нм и волокна коллагена. В зависимости от структуры образца в качестве режима измерения выбирался ARS или DC.
Результат
Полидиметилсилоксан (PDMS): Данный материал был выбран для исследований, поскольку он используется для изготовления контрольных образцов для калибровки метода SICM, а также он используется при изготовлении контактных линз. Исследование PDMS помогает узнать, как ведет себя данный материал в определенных средах. Одной и таких сред является поверхность глаза, которая постоянно смачивается слезной жидкостью – биологическое вещество, содержащее электролиты.
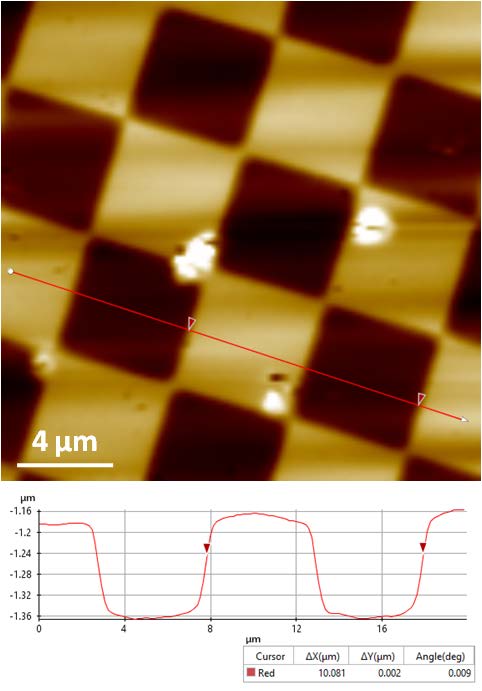
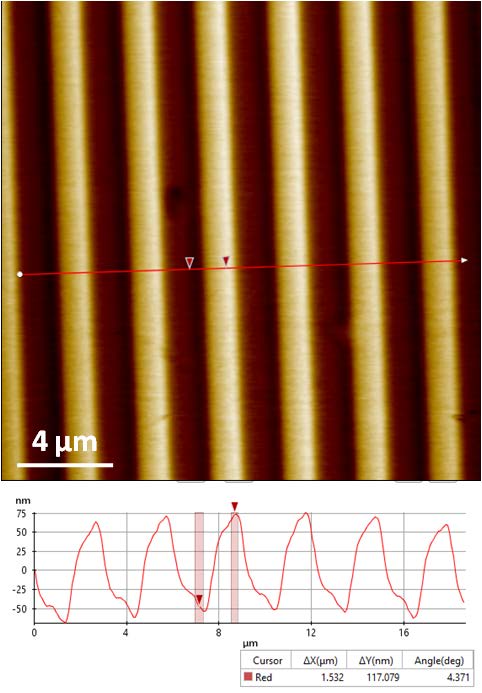
Было исследовано два образца с различной геометрией. Один образец представлял собой матричную структуру с шагом пикселя 10 мкм, а второй образец представлял собой сеточную структуру с планками высотой 117.5 нм. В качестве раствора, в который были помещены исследуемые образцы, использовался натрий-фосфатный буферный раствор (PBS) от компании Thermo Fisher Scientific.
Рис. 2. Топографическое изображение образцов PDMS: матричная структура слева и сеточная структура справа (размер изображения: 20 × 20 мкм, 256 × 256 пикселей; DC режим).
Данные образцы (см. рис. 2) представляют собой стандарты измерения ширины и высоты соответственно. Полученные изображения обладают однозначными и высоко контрастными чертами, характеризующими поверхность. Для обработки полученных данных и количественных вычисления было использовано программное обеспечение XEI компании Park Systems. Результаты измерений обоих образцов подтвердили предполагаемые размеры структуры.
Поликарбонатная мембрана: Нанопоры относятся к дырам с размером от десятков до сотен нанометров, которые находятся в тонких мембранах. Из-за проникновения молекул или белков через поры, данные мембраны могут становиться мощными сенсорами молекул и ионов, что используется в таких областях, как инженерия, химия, биология, медицина и т.п. Последние достижения в области нанотехнологий позволяют точно контролировать морфологию, а также физические и химические свойства пор, чтобы сделать их более склонными для регулирования и переноса на молекулярном уровне [1]. Также, при определенных химических модификациях, мембраны с нанопорами могут использоваться для разделения или фильтрации наночастиц с высокой пропускной способностью [2, 3]. Обширные исследования также проводились в области изготовления, получения свойств и моделировании подобных мембран.
Стандартные методы исследований на АСМ, основанные на силовом взаимодействии кантилевера и поверхности мембраны, оказались не достаточно точными для получения сверхточных данных о поверхности мембран и значениях ионного тока, протекающего через их поверхность. Использование же метода SICM доказало, что обе характеристики могут быть получены с высочайшей точностью [4, 5].
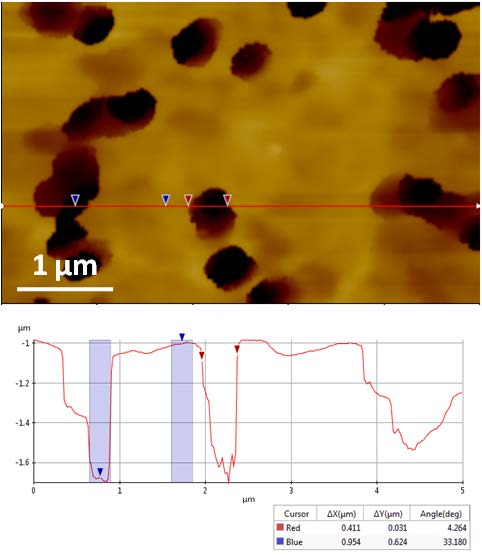
Рис. 3. Топографическое изображение поликарбонатной мембраны с порами диаметром 400 нм (ARS режим).
Для получения изображения мембрана была помещена на подложку из PDMS и в буферный раствор PBS. Для предотвращения повреждения нанопипетки глубокими порами мембраны использовался только ARS режим анализа. На рисунке 3 представлено полученное изображение нанопор. Данные измерений показывают, что средний диаметр нанопор составляет около 416 нм, а их средняя глубина порядка 600 нм. Также были проведены исследования по определению значений ионного тока, протекающего по поверхности мембраны [4, 5].
Волокна коллагена: Образцы коллагена широко используются в качестве образца для измерения биологических свойств мягких материалов. Как и большинство других биологических образцов, волокна коллагена размягчаются и набухают после регидратации и могут покачиваться, если на них воздействует кантилевер. Использование технологии SICM демонстрирует возможности получения высококачественного изображения поверхности коллагена, с чем не справляются другие методы микроскопии.
В ходе эксперимента волокна коллагена были помещены в чашу Петри в буферный PBS раствор. Из-за изменений высоты волокон использовался ARS режим получения изображения. Для обработки полученных данных и построения изображения использовалось программное обеспечение XEP.
Как видно на рисунке ниже, белковые связки, а также каждое отдельное волокно можно четко различить на изображении размером 10 × 10 мкм. Тончайшее волокно, которое можно распознать с помощью метода SICM (на рис. 4 обозначено черной стрелкой), имеет толщину около 90 нм. Учитывая тот факт, что между нанопипеткой и волокнами нет прямого физического взаимодействия, данное разрешение довольно впечатляющее.
Рис. 4. Топографическое изображение (слева) и топографическое изображение с улучшенным контрастом (справа) волокон коллагена (ARS режим).
Заключение
В данной статье описана возможность получения изображений тонких и деликатных структур, находящихся в жидких растворах, с помощью технологии SICM на атомно-силовом микроскопе NX10 компании Park Systems. Данная технология полностью решает проблемы по исследованию в жидких средах, которые появляются при использовании стандартных методов на АСМ, а также она избавлена от такой черты, как прямое воздействие на образец, делая данный метод полностью неинвазивным, что особенно важно при исследовании мягких и чувствительных образцов.
Простота использования и высокая производительность метода SICM предоставляет исследователям возможность получения высококачественных изображений различных объектов, что помогает лучше понять их производительность при различных применениях.
Подробные характеристики атомно-силового микроскопа Park NX10
Ссылки
- Adiga, S.P., et al., Wiley Interdiscip Rev Nanomed Nanobiotechnol, 2009. 1(5): p. 568-581.
- Anmiv, S.P., et al., J. Phys. Condens. Matter, 2010. 22(45): p. 454107.
- Tokarev, I. and S. Minko, Adv. Mater, 2010. 22(31): p. 3446-3462.
- Chen, C., Derylo, M.A. and Baker, L.A., Anal. Chem., 2009. 81(12): p.4742-4751
- 5. Zhou, Y., Chen, C. and Baker, L.A., Anal. Chem., 2012. 84: p.3003-3009