Двухфотонный лазерный 2D сканирующий микроскоп FEMTOSmart
- Высокая гибкость анализа
- Быстрое покадровое сканирование
- Глубокая визуализация тканей in vivo
Производитель Femtonics
Описание
Серия FEMTOSmart представляет собой кастомизируемые двухфотонные микроскопы, которые идеально отвечают потребностям клиентов. Особенностью данных микроскопов является приподнятый на станине корпус, который может перемещаться в направлениях X, Y и Z, предоставляя достаточно места под объективом для оптимального расположения биологических образцов. Данная особенность делает FEMTOSmart пригодными для проведения исследований in vivo в широком спектре моделей организмов, начиная от рыбьих мальков и заканчивая мышами, перемещающимися в виртуальной реальности, или низшими приматами.
Серия FEMTOSmart объединяет в себе три модификации, представляющие собой традиционные двухфотонные системы формирования двумерных изображений, способные выполнять функциональную визуализацию на основе гальванических и резонансных сканеров.
Отличительные особенности
- Приподнятый на станине корпус – большое пространство под объективом
- Позиционирование по XYZ с микронной точностью
- Высокая модульность – широкий выбор измерительных аксессуаров
- Гибкость анализа: гальванометрический, резонансный или два-в-одном
- Запатентованная технология получения изображений: «подвижная» система регистрации
Потенциальные области применения
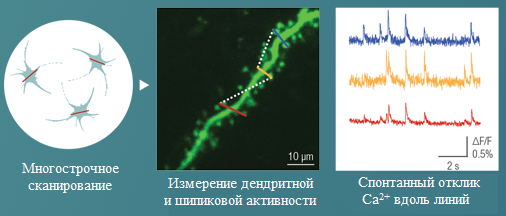
- Сканирование нейронных сетей: гибкие режимы двумерного сканирования, такие как произвольное поточечное сканирование, многострочное сканирование и многокадровое сканирование, поддерживают ручной выбор отдельных клеток на двумерной плоскости. Пропуская измерение всего поля, можно поддерживать высокую скорость сканирования и отношение сигнал/шум. Быстрое покадровое сканирование и его комбинация с быстрой Z-фокусировкой является хорошо известным подходом для изучения двух- и трехмерных нейронных сетей.
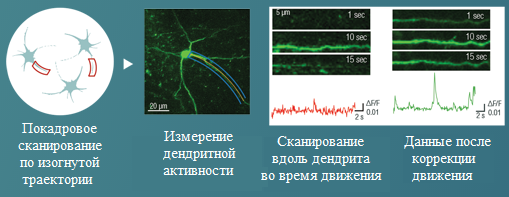
- Сканирование дендритов: используя гибкие режимы двумерного сканирования (например, многострочное сканирование), имеется возможность быстро и точно отслеживать извилистые выступы дендритного разветвления. Микроскопы, оснащенные объективом с пьезо-позиционером или набором жидкостных объективов, позволяют отслеживать разветвление дендритов в 3D и представляют собой экономически эффективные альтернативные решения по сравнению с методами сканирования, основанными на акустооптическом сканировании.
- Трехфотонная визуализация: трехфотонная микроскопия является не инвазивным методом анализа и позволяет получать функциональные изображения, делая клетки видимыми в глубоких тканях, с высоким пространственным разрешением и лучшей контрастностью по сравнению с двухфотонным возбуждением. Более длинные длины волн возбуждения меньше рассеиваются в биологических тканях, что делает возможным увеличение глубины проникновения, уменьшает возбуждение вне фокуса и увеличивает отношение сигнал/шум.
- Фотостимуляция: для стимуляции клетки или субклеточных компонентов необходимо быстро направлять лазерный луч по всему полю зрения, используя LED источник света, или оптимизировать схему сканирования, используя на одном оптическом пути сразу несколько лазеров, производя на выходе сканирование вдоль точки, линии, спирали или зигзага. Тогда как поточечное сканирование или вдоль линий позволяет проводить стимуляцию в определенных областях, таких как шипики или дендриты, спиральное и зигзагообразное сканирование, охватывающее большие области, позволяют одновременно стимулировать множество молекул на соме.
- Разарретирование (Uncaging): данный процесс означает активацию молекул с биохимической маскировкой посредством фотолиза, который имитирует физиологическое высвобождение биологически активных соединений. Этот метод широко используется в нейробиологии, где биологически активной молекулой обычно является глутамат или другой нейротрансмиттер. Используя двухфотонную фотостимуляцию с ультрабыстрым импульсным инфракрасным лазерным излучением, может быть достигнуто очень точное выделение таких соединений в очень малых объемах. Двухфотонная визуализация позволяет прослеживать изменения в дендритах или шипиках, а также исследовать распределение рецепторов на нейронах.
Благодаря объединению передовых дизайнерских решений с инновационными технологиями нам удалось создать уникальную систему FEMTOSmart, не имеющую аналогов на мировом рынке:
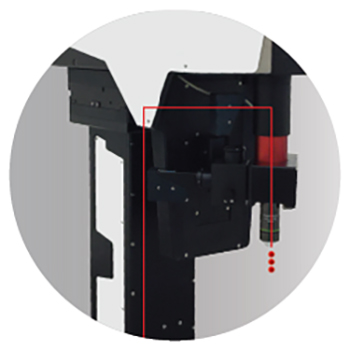
- Свобода позиционирования: в перемещающемся по XYZ корпусе FEMTOSmart размещены сканер, элементы управления и оптическая схема. Приподнятый корпус позволяет размещать под объективом микроскопа любой движущийся столик или систему виртуальной реальности. Сканирование образца осуществляется с помощью двух моторов: один перемещает объектив вдоль оси Z в диапазоне 50 мм; второй позволяет перемещать корпус самого микроскопа в плоскости XY в диапазоне 50 мм.
- Высокая модульность: модульная конструкция микроскопа позволяет осуществлять сборку компонентов, их перекомпоновку и модернизацию системы в целом, чтобы полностью соответствовать потребностям конечных пользователей. К микроскопу могут быть подключены несколько лазеров, необходимых как для визуализации, так и для фотокатализа. FEMTOSmart может быть оснащен множеством дополнительных модулей, позволяющих адаптировать его к широкому спектру биологических применений, таких как оптогенетика, сканирование дендритов или разарретирование.
- Превосходная визуализация: точно настроенная оптическая схема позволяет получать изображения на глубине до 850 мкм, а диапазон длин волн от видимой до инфракрасной области спектра позволяет проводить измерения в режиме трехфотонного возбуждения. Регистрация сигнала осуществляется по нашей запатентованной технологии подвижного детектирования, в которой высокоточные InGaAs ФЭУ и сопряженные с ними оптические компоненты установлены на специальном рельсе, расположенном как можно ближе к объективу, что помогает поддерживать высокий коэффициент регистрации фотонов.
Модификация FEMTOSmart Galvo
Гальваносканер в сочетании с нашим интеллектуальным программным обеспечением позволяет выбирать различные режимы сканирования, охватывающие широко распределенные области интереса для анализа. Многокадровое сканирование позволяет сфокусироваться на клеточных телах, многострочное сканирование позволяет отслеживать биопотенциалы вдоль дендритов, произвольное поточечное сканирование позволяет измерять или фотостимулировать субклеточные компоненты с высочайшим временным разрешением. А наше программное обеспечение (отображение в реальном времени, различные функции анализа, алгоритм вычисления ΔF/F, параллельный сбор данных) помогает понять физиологические процессы Ваших исследований.
Таким образом, FEMTOSmart Galvo позволяет Вам сканировать различные области интереса, обеспечивая быструю визуализацию и высокое отношение сигнал/шум за счет устранения фоновых шумов.
Ключевые особенности
- Каждое клеточное тело, аксон, дендрит или шипик могут быть измерены по отдельности
- Гибкие режимы сканирования и запатентованные технологии для быстрой визуализации
- Высокое отношение сигнал/шум
- Интеллектуальное программное обеспечение
Модификация FEMTOSmart Resonant
Быстрый резонансный сканер, используемый в данной модификации, позволяет выполнять высокоскоростное и высокочувствительное сканирование живых тканей. Растровое сканирование на основе резонансного сканера позволяет получать изображения со скоростью 31 кадр в секунду, что примерно в 5 раз быстрее, чем сканирование на основе гальваносканера по всему полю зрения объектива. Скорость резонансного сканера нелинейна: она различна в центре и по краям кадра. Используемая в микроскопе ячейка Поккельса ограничивает диапазон сканирования участком, где скорость сканирования близка к линейной, что позволяет избежать фотообесцвечивания и/или фотоповреждений с обеих сторон изображения. Сканирующая электроника выполняет динамическое облучение пикселей для линеаризации данных и для устранения искажения изображения.
Данный подход делает FEMTOSmart Resonant наиболее подходящим решением для быстрого покадрового или объемного сканирования.
Ключевые особенности
- Быстрое получение изображения
- Длительная съемка / Замедленная съемка
- Возможность апгрейда для трехмерного объемного сканирования
- Интеллектуальное программное обеспечение
Модификация FEMTOSmart Dual
FEMTOSmart Dual – это комбинация микроскопов Galvo и Resonant, предоставляющая все преимущества обеих технологий визуализации. Гальваносканер направляет лазер точно и избирательно на клетки или субклеточные компоненты по выбору оператора, тогда как с помощью резонансного сканера пользователь может отслеживать события, собирая данные одновременно с высокой скоростью сканирования.
Ключевые особенности
- Совместная работа резонансного и гальваносканера
- Гибкость и быстрота при анализе интересующей области
- Интеллектуальное программное обеспечение
Примеры сканирования
- Многострочное сканирование: данный режим был разработан для исследователей, целью которых является различие дендритной и даже шипиковой активности нейронов с помощью измерений практически в реальном времени. В этом режиме сканирования зеркала X и Y гибко направляют лазерный луч по прямым линиям или сложным кривым. Сканер большую часть времени собирает сигналы с этих линий, пропуская промежуточные участки между ними. Следовательно, скорость сканирования и отношение сигнал/шум для данных, получаемых из нескольких анализируемых областей, увеличивается в 3-4 раза по сравнению с покадровым сканированием (Galvo).
- Покадровое сканирование по изогнутой траектории: данный запатентованный режим позволяет пользователям отображать ограниченную выбранную область вдоль линии, форма которой может быть прямой или изогнутой. Такой режим сканирования полезен для визуализации одноклеточных тел в различных областях образца или для отслеживания процессов вдоль изгибающихся дендритов, например, в тканях движущихся животных (Galvo).
- Модельная фотостимуляция: наши режимы сканирования и их комбинации также поддерживают оптогенетику, разарретирование и другие методы фотостимуляции. Например, произвольное поточечное сканирование может использоваться для стимуляции в объемах порядка фемтолитра вблизи дендритных шипиков, где продолжительность стимуляции может быть установлена от микросекунд до единиц секунд. Индуцированные сигналы вдоль дендрита могут отслеживаться путем линейного сканирования практически одновременно с фотостимуляцией (Galvo).
Клетки, распределенные в одном или нескольких слоях, можно стимулировать и получать их изображения с высокой скоростью, используя резонансный микроскоп, оснащенный точно синхронизированными LED источниками света. Доступны диоды с разными длинами волн возбуждения, например, 473 нм для ChR2 или 561 нм для NpHR. Это делает микроскоп пригодным для проведения оптогенетических экспериментов. Время переключения в доли микросекунд между стимуляцией и детектированием достигается с помощью ячейки Поккельса и стробированного детектирования (Resonant).
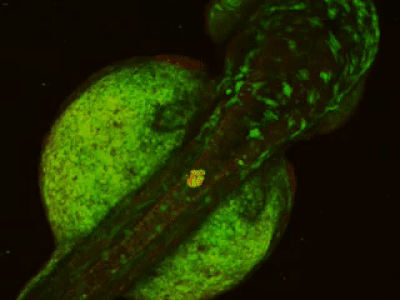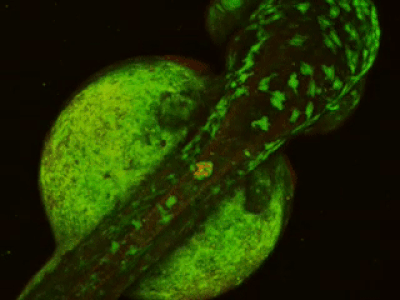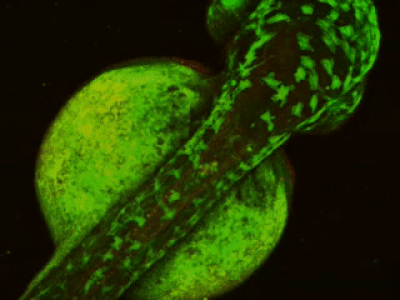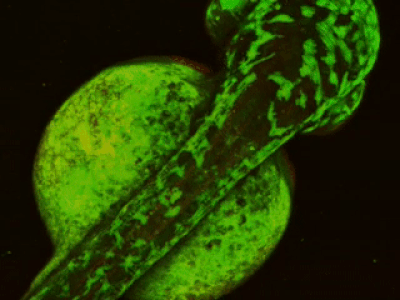
- Длительная/замедленная съемка: тогда как двухфотонное возбуждение обеспечивает большую глубину сканирования и высокое пространственное разрешение, высокая частота сканирования резонансного сканера обеспечивает высокое временное разрешение. Это означает, что микроскоп подходит для измерения быстрых процессов в живых клетках, нейронных сетях или других цепях. Высокая частота сканирования кадров и неограниченная потоковая передача видео, объединенные с возможностью выполнения автоматических измерений, предоставляют возможность проведения длительных исследований, таких как отслеживание процессов обучения, извлечение памяти, ассоциативное обучение, развитие модельных организмов и т. д. Ниже представлена ранняя стадия развития эмбриона рыбок данио, онтогенез которого отслеживался и регистрировался в течение дня (Resonant).
- Объемное трехмерное сканирование: быстрое XY-сканирование, объединенное с быстрым перемещением вдоль оси Z позволяет проводить 3D измерение объема практически в реальном времени, что дает возможность изучать изменения активности в 3D клеточных сетях или морфологию органов. Перемещение вдоль оси Z может быть выполнено с помощью объектива с пьезо-позиционером или жидкостного объектива одним из двух доступных режимов сканирования: покадровое объемное и внутрикадровое наклонное (Resonant).
Характеристики
Программное обеспечение MESc
Аксессуары
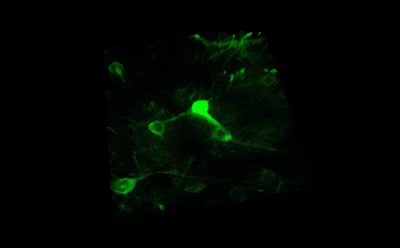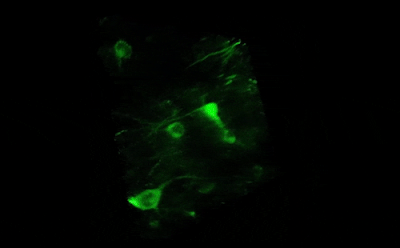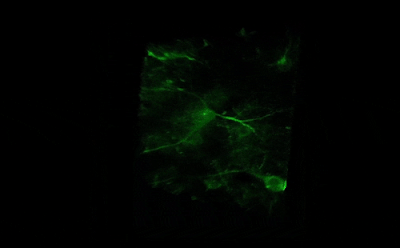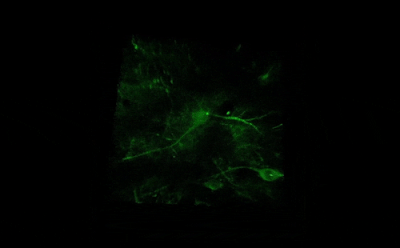
Сканирование нейронных сетей
Все ощущения и поведенческие алгоритмы закодированы в динамических моделях активности нейронных сетей. Другими словами, сложные сети из множества отдельных нейронов реагируют на особенности окружающей среды, зрительные или слуховые возбудители, поощрение или наказание и т. д. Подробнее...
Сканирование дендритов
Дендриты и дендритные шипики состоят из тонких, слабых и уязвимых отростков, поэтому их трудно изучать. Однако, используя двухфотонную лазерную микроскопию, мы можем собирать сигналы от фемтолитровых объемов более глубоких областей мозга, одновременно избегая фототоксических реакций. Подробнее...
Трехфотонная визуализация
Трехфотонная (3P) микроскопия является не инвазивным методом анализа и позволяет получать функциональные изображения, делая клетки видимыми в глубоких тканях, с высоким пространственным разрешением и лучшей контрастностью по сравнению с двухфотонным возбуждением. Подробнее...
Фотостимуляция/оптогенетика
Фотостимуляция может быть индуцирована с использованием видимого или инфракрасного света, а сканирование выполняется с помощью фемтосекундного ИК-лазера. Переключение между стимуляцией и визуализацией осуществляется за время менее миллисекунды. Подробнее...
Разарретирование
Разарретирование клетки означает активацию молекул с биохимической маскировкой посредством фотолиза, который имитирует физиологическое высвобождение биологически активных соединений. Этот метод широко используется в нейробиологии, где биологически активной молекулой обычно является глутамат или другой нейротрансмиттер. Подробнее...
1. Metaplasticity at CA1 Synapses by Homeostatic Control of Presynaptic Release Dynamics Cary Soares, Kevin F.H. Lee, Jean-Claude Béïque
2. Neuroplastin and Basigin Are Essential Auxiliary Subunits of Plasma Membrane Ca2+-ATPases and Key Regulators of Ca2+ Clearance Nadine Schmidt, Astrid Kollewe, Cristina E. Constantin, Sebastian Henrich, Andreas Ritzau-Jost, Wolfgang Bildl, Anja Saalbach, Stefan Hallermann, Akos Kulik, Bernd Fakler, Uwe Schulte
3. Loss of Saltation and Presynaptic Action Potential Failure in Demyelinated Axons Mustafa S. Hamada, Marko A. Popovic, Maarten H. P. Kole
4. Cell-type–specific inhibition of the dendritic plateau potential in striatal spiny projection neurons Kai Du, Yu-Wei Wu, Robert Lindroos, Yu Liu, Balázs Rózsa, Gergely Katona, Jun B. Ding, and Jeanette Hellgren Kotaleski
5. Linking Neurons to Network Function and Behavior by Two-Photon Holographic Optogenetics and Volumetric Imaging Marco dal Maschio, Joseph C. Donovan, Thomas O. Helmbrecht, Herwig Baier
6. Multimodal Characterization of Neural Networks Using Highly Transparent Electrode Arrays Mary J. Donahue, Attila Kaszas, Gergely F. Turi, Balázs Rózsa, Andrea Slézia, Ivo Vanzetta, Gergely Katona, Christophe Bernard, George G. Malliaras and Adam Williamson
7. Monitoring Ca2+ elevations in individual astrocytes upon local release of amyloid beta in acute brain slices Olga Tyurikova, Kaiyu Zheng, Annika Rings, Anna Drews, David Klenerman, Dmitri A. Rusakov
8. Large-conductance Ca2+-activated potassium channels are potently involved in the inverse neurovascular response to spreading depolarization Ákos Menyhárt, Attila E. Farkas, Dániel P. Varga, Rita Frank, Réka Tóth, Armand R. Bálint, Péter Makra, Jens P. Dreier, Ferenc Bari, István A. Krizbai, Eszter Farkas
9. Single synaptic inputs drive high-precision action potentials in parvalbumin expressing GABA-ergic cortical neurons in vivo Jean-Sébastien Jouhanneau, Jens Kremkow & James F. A. Poulet
10. Parallel emergence of stable and dynamic memory engrams in the hippocampus Thomas Hainmueller & Marlene Bartos
11. Dendritic NMDA receptors in parvalbumin neurons enable strong and stable neuronal assemblies Jonathan H Cornford, Marion S Mercier, Marco Leite, Vincent Magloire, Michael Häusser, Dimitri M Kullmann
12. Method for spike detection from microelectrode array recordings contaminated by artifacts of simultaneous two-photon imaging Gábor Orbán, Domokos Meszéna, Kinga Réka Tasnády, Balázs Rózsa, István Ulbert, Gergely Márton
13. Altered dendritic spine function and integration in a mouse model of fragile X syndrome Sam A. Booker, Aleksander P. F. Domanski, Owen R. Dando, Adam D. Jackson, John T. R. Isaac, Giles E. Hardingham, David J. A. Wyllie & Peter C. Kind
14. A silicon-based spiky probe providing improved cell accessibility during in vitro slice recordings Domokos Meszéna, Bálint Péter Kerekes, Ildikó Pál, Gábor Orbán, Richárd Fiáth, Tobias Holzhammer, Patrick Ruther, István Ulbert, Gergely Márton
15. Fluorescence-Based Quantitative Synapse Analysis for Cell Type-Specific Connectomics Dika A. Kuljis, Eunsol Park, Cheryl A. Telmer, Jiseok Lee, Daniel S. Ackerman, Marcel P. Bruchez and Alison L. Barth