Автор: ГалинаРаздел: Анализ микроструктуры материалов
Автор: ГалинаРаздел: Анализ микроструктуры материалов
Автор: ГалинаРаздел: Спектроскопия
Автор: ГалинаРаздел: Анализ микроструктуры материалов
Автор: ГалинаРаздел: Анализ микроструктуры материалов
Автор: Раздел: Атомно-силовая микроскопия
Автор: ГалинаРаздел: Анализ микроструктуры материалов
Автор: ВикторРаздел: Атомно-силовая микроскопия
Автор: ВикторРаздел: Атомно-силовая микроскопия
Автор: ВикторРаздел: Атомно-силовая микроскопия
Нажимая кнопку «Подписаться», вы принимаете условия «Соглашения на обработку персональных данных».
Атомно-силовая биомикроскопия с помощью АСМ компании Park Systems

В современном мире биотехнологические исследования и диагностика оказывают прямое воздействие на качество жизни человека. Текущие достижения в данной области имеют бесчисленное множество применений в таких сферах, как здравоохранение, фармакология, сельское хозяйство и др. С течением времени исследователи сталкиваются с новыми проблемами и вопросами, получение ответов на которые могут помочь лучше понять устройство мира и явления в жизни. Некоторые из ответов скрываются на границах наномира. И использование такой технологии, как атомно-силовая микроскопия (АСМ), в областях науки о жизни позволяет ученым начать исследования и раскрывать неизведанные тайны на уровне наномасштабов.
Научно-исследовательские лаборатории, в которых установлены атомно-силовые микроскопы компании Park Systems, имеют возможность получать точные топографические данные о морфологическом строении биологических образцов с нанометровым разрешением без особых усилий. Одним из частных случаев АСМ является дистанционно-силовая микроскопия – данный метод измерений предоставляет возможность получения данных о различных физико-механических свойствах биоматериалов, таких как вязкость, жесткость, сила адгезии и даже модуль упругости Юнга с точностью до долей наноньютонов (нН).
Анализ топографии липосом и пузырьков
Липидный бислой, образуемый при объединении фосфолипидных везикул, недооценен исследователями при изучении характеристик и поведения мембраносвязанных белков, клеточных мембран и сигнальной трансдукции. Анализ фосфолипидных везикул или липосом также очень важен при изучении секреторных пузырьков.
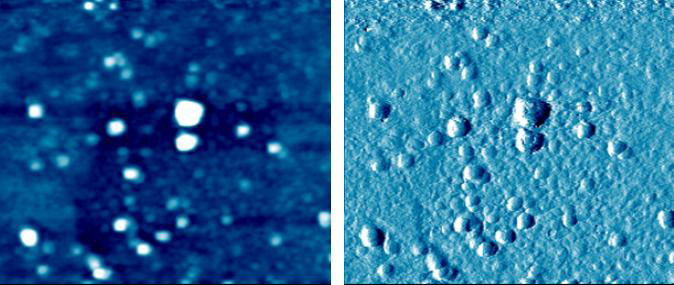
Рис. 1. АСМ изображение липосом в жидкости, полученное с помощью микроскопа XE7 в бесконтактном режиме (размер изображения 2 × 2 мкм).
Везикула это относительно небольшая и замкнутая ячейка, отделенная от гиалоплазмы по крайней мере одним липидным бислоем. Везикула – это простейшая органелла в клетке. Эти везикулы используются для химических реакций, хранения ферментов и как транспортирующее средство.
Миграция везикул является общей причиной проявления многих патологий человека. Дисфункция миграции везикул при целенаправленном воздействии и доставке специфичных белков к поверхности клетки имеет серьезные последствия и наблюдается при таких заболеваниях как, например, Альцгеймер, муковисцидоз, диабет второго типа и поликистозные заболевания почек.
АСМ может использоваться при изучении динамики размера везикулы в замкнутой ячейке с жидкостью. Динамику разбухания везикул и взаимодействие с мембранами-мишенями можно визуализировать с высоким разрешением.
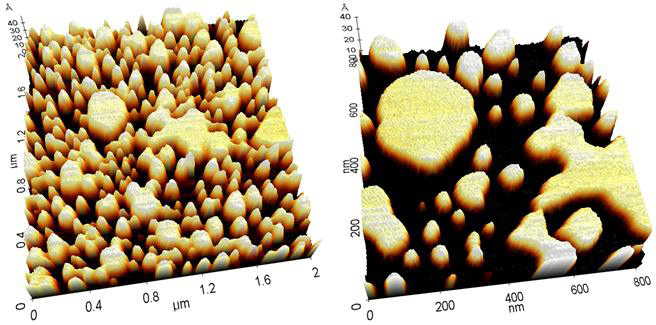
Рис. 2. Трехмерная модель топографического изображения липосом в жидкости.
Фосфолипидные везикулы или липосомы могут имитировать секреторные пузырьки, такие как зимогенные гранулы или синаптические везикулы, путем включения везикулярных белков. Могут быть проведены фундаментальные исследования лиганд-рецепторного взаимодействия везикулярных мембран, адгезии и объединения мембран и многие другие биофизические явления.
Рис. 3. Топографические изображения липосом в жидкости.
С помощью определенных подложек, таких как оксид титана, который препятствует адсорбции липидов, АСМ может просканировать липосомы. Бесконтактный режим АСМ серии ХЕ особенно полезен для сканирования ультрамягких материалов, таких как липосомы в жидкости.
Анализ формирования двухслойной структуры из липосом (липидный бислой)
Фосфолипидные бислои важны в биологии, так как они образуют основную структуру всех плазматичеких мембран всех живых клеток. Плазматическая мембана, окружающая живую клетку, выполняет несколько функций, таких как контроль проницаемости растворенного вещества и распознавание.
АСМ – это идеальный интрумент для изучения как физических, так и химических характеристик этих мембран на высоком локальном уровне, так как он позволяет получать изображения высокого разрешения прямо в жидкости.
Липидный бислой обычно наносится на подложку с помощью так называемой технологии объединения везикул. На рис. 4 показано топографическое изображение частично сглаженных везикул и липидных бислоев. Изображение было получено с помощью контактного метода в буферном растворе. Когда везикулы попадают на подходящую твердую поверхность, они могут адсорбироваться, распадаться и рассеиваться с образованием бислоя на гидрофильной поверхности. В результате объединенные везикулы образуют плоские домены, которые покрывают большую часть твердой поверхности (см. рис. 5 и 6).
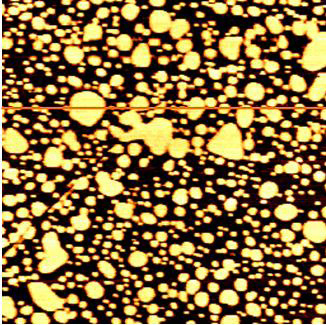
Рис. 4. Топографическое изображение липидного бислоя и везикул в жидкости (размер изображения 3 × 3 мкм).
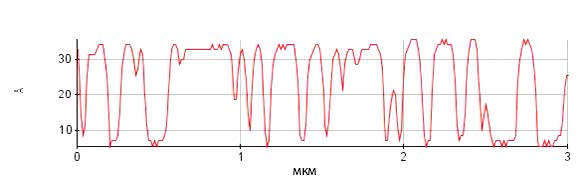
Рис. 5. Профиль поперечного сечения липидных везикул и бислоя на поверхности слюды вдоль красной линии для топографического изображения на рис. 4.
Последовательный процесс объединения везикул, такой как адсорбция, распад и рассеивание, может быть изучен на каждой стадии с помощью атомно-силового микроскопа. Кроме динамических процессов, АСМ также можно использовать для получения изображения липидно-белкового слоя смешанного с фосфолипидным бислоем для дальнейшего изучения. Также имеется возможность разделения различных типов фосфолипидов на определенные домены, так как между данными типами существует разница в высоте или топографической структуре.
Рис. 6. Трехмерные модели топографических изображений липидного бислоя и везикул в жидкости.
Благодаря отличному разрешению, АСМ серии ХЕ подходят для исследования фундаментальных свойств липидных мембран, таких как динамика, структура и бимолекулярные взаимодействия.
Пикосиловая микроскопия для анализа взаимодействия единичных нуклеотидов ДНК
С помощью силовой микроскопии можно наблюдать взаимодействия между одиночными молекулами путем контроля сил притяжения или характерных скачков сигнала, связанных с молекулярными связями. Эксперименты молекулярного связывания, представленные Jung и др. (2007), повторили с использованием атомно-силового микроскопа серии ХЕ под руководством профессора Park.
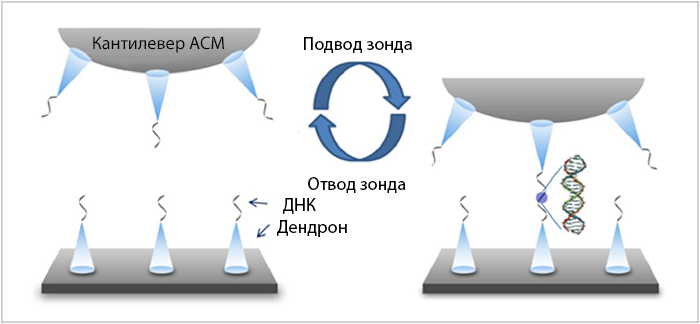
Анализ олигонуклеотидных цепей, иммобилизованных на дендрон-модифицированной поверхности, с помощью дистанционно-силовой (F-d) кривой показал ассоциацию и диссоциацию двойной спирали ДНК. Силовая постоянная кантилевера была откалибрована в растворе для каждого измерения с помощью температурного метода настройки – значение колебаний составляло 12-15 пН/нм.
Рис. 7. Процесс химического присоединения 50 нуклеотидов ДНК, включающий в себя самоорганизованные монослои ДНК-функциональных дендронов. Дендроном, использованным в данной работе, был 9 –антрилметил N-([{трис({2-[({трис-х(2-карбоксиэтокси)метил]метил}амино)карбонил]этокси}метил)-метил) –метил]амино}карбонил) пропил карбомат. Образец предоставлен профессором J.W Park (каф. химии, POSTECH).
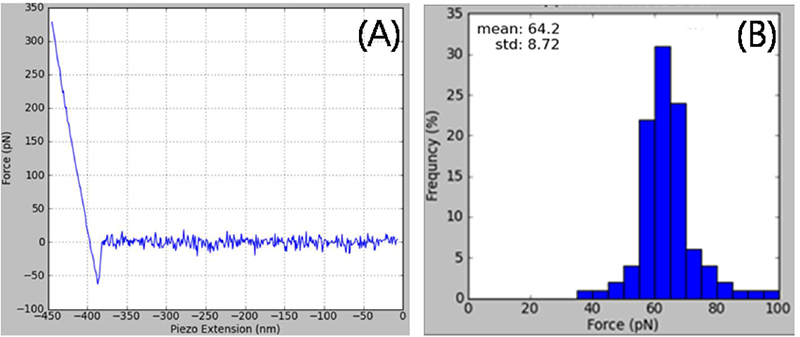
Рис. 8. (А) Типичная F-d кривая взаимодействия между зондом с ДНК и комплементарной 50-мерной ДНК. (В) Гистограмма несвязанных, полученных на основе данных F-d кривой. Среднее значение в 64 пН с узким распределением показывает, что АСМ можно использовать в качестве инструмента для изучения взаимодействия между одиночной молекулой ДНК и другими одиночными молекулами ДНК, молекулами РНК и белками.
Подробные характеристики атомно-силового микроскопа Park ХЕ7