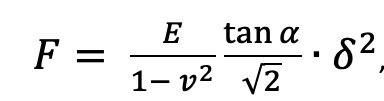Автор: ГалинаРаздел: Анализ микроструктуры материалов
Автор: ГалинаРаздел: Анализ микроструктуры материалов
Автор: ГалинаРаздел: Спектроскопия
Автор: ГалинаРаздел: Анализ микроструктуры материалов
Автор: ГалинаРаздел: Анализ микроструктуры материалов
Автор: Раздел: Атомно-силовая микроскопия
Автор: ГалинаРаздел: Анализ микроструктуры материалов
Автор: ВикторРаздел: Атомно-силовая микроскопия
Автор: ВикторРаздел: Атомно-силовая микроскопия
Автор: ВикторРаздел: Атомно-силовая микроскопия
Нажимая кнопку «Подписаться», вы принимаете условия «Соглашения на обработку персональных данных».
Измерение механических свойств живых и зафиксированных клеток с помощью атомно-силовой и сканирующей ион-проводящей микроскопии
В процессе сохранения клеточных образцов фиксация клетки играет важную роль для широкого спектра биологических исследований. Чтобы определить важность этой процедуры, был проведен сравнительный анализ между живыми и зафиксированными клетками с использованием методов сканирующей зондовой микроскопии (SPM), таких как атомно-силовая микроскопия (АСМ) и сканирующая ион-проводящая микроскопия (SICM), для измерения механических свойств и перепадов поверхности, соответственно. Результаты этих методов дают широкое понимание того, как фиксация клеток влияет на механические свойства клеток, и открывают новые возможности для создания протоколов фиксации клеток.
Введение
Одной из основных задач при фиксации клеток для исследований in vitro является сохранение клетки или клеточных компонентов в жизнеспособном состоянии путем сохранения основных химических и физических характеристик клеток. Фиксация клеток также полезна при иммуноокрашивании, позволяя антителам получать доступ к внутриклеточным структурам [1]. Сравнение живых и зафиксированных клеток показывает, что зафиксированная клетка сохраняет более однородное строение по всей поверхности клетки [2]. Однако не существует систематической оценки или корреляции между изменениями механических свойств живых и зафиксированных клеток. Наблюдая за различными состояниями фиксации клеток и живых клеток, есть возможность оптимизировать протоколы фиксации клеток и получить ценные знания, помогающие процессу фиксации клеток. Существует множество фиксирующих агентов для сшивания клеточных мембран и цитоплазматических белков, причем параформальдегид (PFA) наиболее широко используется для образцов клеток и тканей [1-3]. PFA работает путем ковалентного поперечного сшивания молекул, связывая их вместе и создавая нерастворимую сетку, которая изменяет механические свойства поверхности клетки. Чтобы исследовать механические свойства живых и зафиксированных с помощью PFA клеточных структур, были использованы атомно-силовая микроскопия (АСМ) и сканирующая ион-проводящая микроскопия (SICM) для измерения модуля упругости и поверхностных перепадов соответственно [3-6].
Эксперимент
Клеточный образец
Используемый клеточный образец состоял из мышиных фибробластных клеток L929 (ATCC, США), культивируемых в среде Игла, модифицированной по способу Дульбекко (DMEM; Invitrogen Life Technique, США), дополненной 10% фетальной бычьей сывороткой (Thermo Fisher Scientific, США) вместе с 1% пенициллина/стрептомицина (Invitrogen Life Technique, США) при 37°Cво влажной среде с концентрацией CO2в 5%. Клетки (с плотностью 1 × 104/мл) помещали в чашу Петри диаметром 35 мм для культивирования клеток (NUNC, Дания), трижды промывали физиологическим раствором с фосфатным буфером (PBS, Sigma-Aldrich, США) и обрабатывали 4% раствором PFA в течение 5 минут. Образцы зафиксированных клеток три раза промывали с PBS до проведения экспериментов с помощью АСМ и SICM.
Экспериментальная установка
Установка для сканирования клеток состояла из сканирующего зондового микроскопа Park NX-Bioкомпании Park Systems (Корея), оснащенного инвертированным оптическим микроскопом (Nikon Corp., Япония), специально разработанного для биологических исследований. АСМ может получать механические свойства образца, а также информацию о топографии поверхности клеток мягкого материала с использованием SICM. Все эксперименты, выполненные на живых клетках, проводились в специальных ячейках. Условия в ячейке для поддержания жизнеспособности клетки регулировались по следующим значениям: температура до 37°C, газовая смесь с 5% CO2и 95% влажность. Также ячейка была заполнена необходимой буферной средой.
АСМ измерения модуля Юнга
АСМ использовался для получения силовой кривой для оценки модуля Юнга клеток. Был использован коммерческий кантилевер (BL-AC40TS, Olympus, Япония) с номинальной жесткостью пружины <0.09 Н/м. Использование такого кантилевера с малой жесткостью обеспечивает относительно большой прогиб при приложении небольшого усилия и обеспечивает надежный сбор данных о структуре поверхности клетки. Калибровка жесткости пружины кантилевера АСМ проводилась методом термических колебаний. Измерения были выполнены с использованием 50 силовых кривых, содержащих 512 точек данных каждая (рис. 1а). Для анализа кривых была применена модель Герца с использованием программы для анализа изображений XEI. Предполагается, что форма острия кантилевера представляет собой четырехгранную пирамиду с углом полуконуса α. В результате сила F, приложенная к кантилеверу, выражается как:
где E– модуль Юнга, ν– коэффициент Пуассона, δ– глубина индентирования.
Коэффициент Пуассона был установлен на 0.5, угол α выбран в 35°. Скорость сканирования была установлена на 1 мкм/с, а максимальная сила прижатия равнялась 8 нН.
SICM измерения для получения изображения и анализа топографии
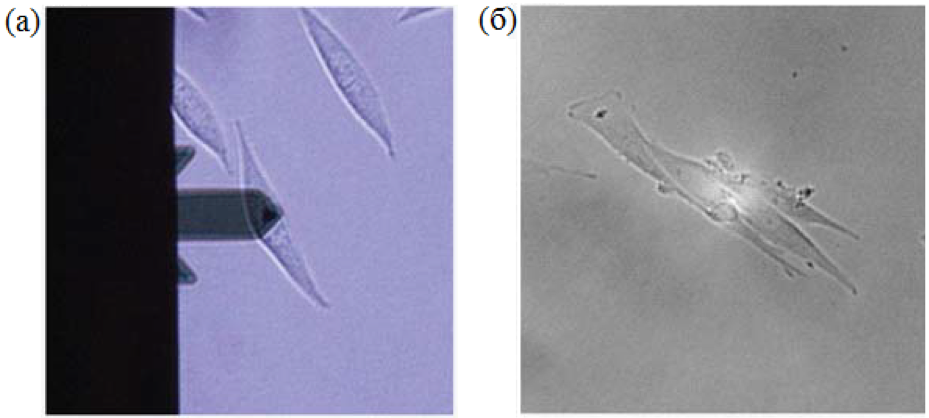
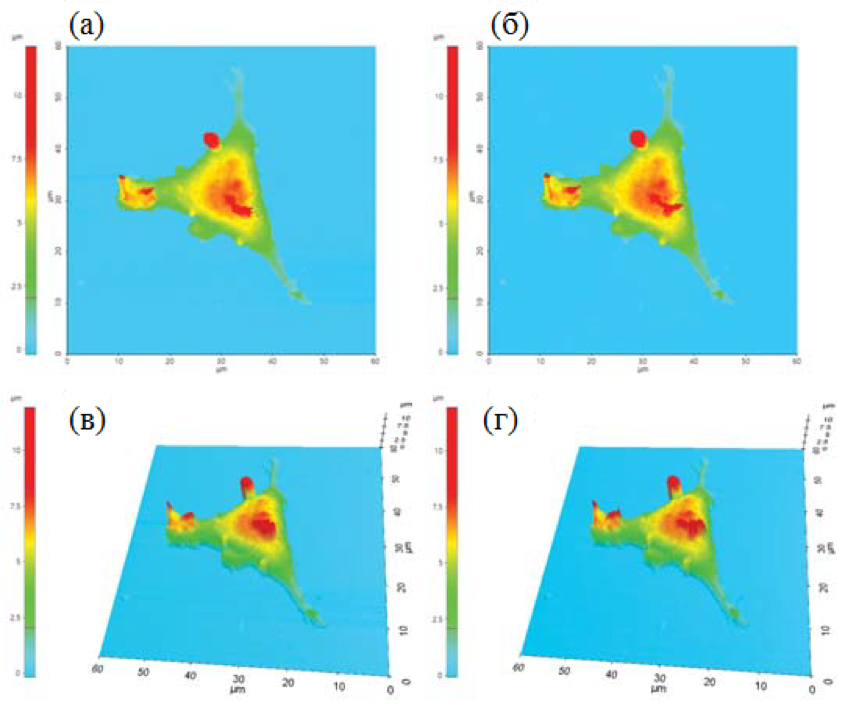
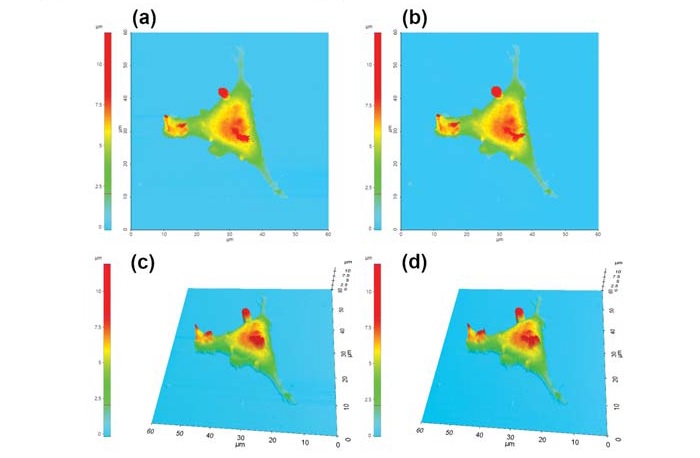
SICM использует ионный ток, который протекает между электродом, размещенным внутри нанопипетки, и внешним электродом, расположенным в растворе (рис. 1б). Ионный ток обеспечивает сигнал обратной связи, который поддерживает постоянное расстояние от кантилевера до образца и позволяет нанопипетке собирать топографическую информацию. Несмотря на низкое латеральное разрешение (≈30 нм) [7], SICM может проводить полезные топографические измерения без необходимости приложения механических сил к поверхности образца. На рисунке 2 показаны топографические изображения живой и зафиксированной клетки L929. На первый взгляд, между двумя случаями нет разницы; однако, поверхность зафиксированной клетки более шероховатая из-за сшивания белков клеточной мембраны. Для проведения SICM-сканирования и экспериментов с дистанционно-токовой кривой (I-D кривая) были изготовлены нанопипетки с внутренним диаметром 80 нм из боросиликатных капилляров (внутренний диаметр 0.6 мм, внешний диаметр 1.0 мм, World Precision Instruments, SSA) с использованием вытягивателя на основе CO2лазера (Sutter Instruments, США).
Рис. 1. Оптические изображения клетки L929 для методов АСМ (слева) и SICM(справа). Кантилевер располагался на вершине одной клетки.
Рис. 2. Топографические SICM изображения (2Dи 3D) поверхности живой (а; в) и обработанной 4% раствором PFA(б; г) клетки.
Результаты измерений
Модуль Юнга живой и зафиксированной клеток
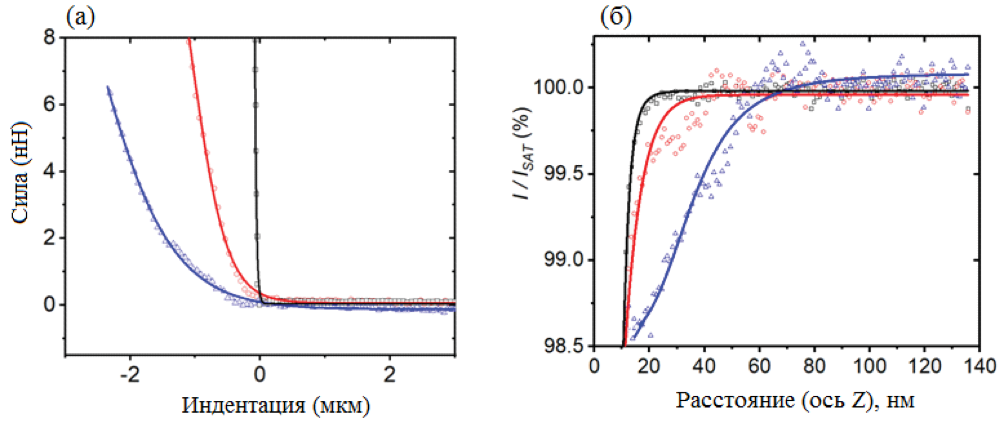
Чтобы определить жесткость поверхности живой и зафиксированной клеток, были проведены измерения методом силовой спектроскопии для живых клеток, зафиксированных клеток, а также твердой подложки. Полученные дистанционно-силовые кривые (FDкривые) представлены на рис. 3а. Зафиксированные клетки показывают значительно более крутой наклон FDкривой по сравнению с живыми клетками. Кроме того, сила, необходимая для индентирования, также больше для зафиксированных клеток, чем для живых клеток. В таблице 1 представлены средние значения модуля Юнга, которые показали, что жесткость зафиксированных клеток (77.95 кПа) была выше, чем у живых клеток (8.11 кПа). АСМ измерения жесткости клеток показали, что действующие нитевидные структуры сильно влияли на жесткость. Еще одной заметной особенностью является то, что обработка PFA влияет на поперечное сшивание белков клеточной поверхности, в том числе волокон F-актина. Кроме того, было отмечено, что жесткость клеток соответствует поперечному сшиванию белков [8]. Более конкретно, можно предположить, что процесс фиксации PFA имеет прямую связь с увеличением жесткости клеток в зависимости от количества случайно распределенных мест образования поперечных связей, доступных на поверхности клетки [9].
| Концентрация параформальдегида | Модуль Юнга | |
| Среднее значение | Стандартное отклонение | |
| Живая клетка, 0% | 8.11 кПа | 2.93 кПа |
| Зафиксированная клетка, 4% | 77.95 кПа | 8.16 кПа |
| Твердая подложка | 3.94 кПа | 0.11 кПа |
Таблица 1. Рассчитанные значения модуля Юнга.
Изменения топографии живой и зафиксированной клеток
Для получения информации об изменении топографии поверхности клетки методом SICMбыли получены I-Dкривые для живых клеток, зафиксированных клеток и твердой подложки. Данные кривые (см. рис. 3б) показывают самый крутой наклон для твердой подложки (чаша Петри), тогда как живая необработанная клетка характеризуется кривой с наименьшим углом наклона. Для клеток, обработанных PFA, I-D кривая занимает промежуточное положение. Следовательно, можно сделать вывод, что живые клетки продемонстрировали большую биологическую активность по сравнению с зафиксированными клетками. Процесс обработки раствором PFA приводит к меньшим перепадам по высоте вдоль поверхности для зафиксированных клеток, чему соответствует поперечное сшивание белков между мембраной и цитоплазматическими белками.
Рис. 3. Усредненные дистанционно-силовые кривые (а) и дистанционно-токовые кривые (б) твердой подложки (черная), зафиксированной клетки (красная) и живой клетки (синяя).
Заключение
Принципиальное различие механических свойств было продемонстрировано путем сравнения живых клеток и клеток, зафиксированных с помощью PFA. Атомно-силовая микроскопия и сканирующая ион-проводящая микроскопия выявили определенный переход в топографических перепадах и модуле упругости клеток при воздействии на них раствором PFA. После полной фиксации с помощью PFA топографические перепады по высоте клетки уменьшились по сравнению с живой клеткой, а модуль Юнга увеличился практически в 10 раз. Эти результаты дают ключевое представление о том, как клетки реагируют на химическую обработку с помощью PFA. В дополнение к традиционным знаниям о химическом воздействии параформальдегида на клетки, в этом исследовании было обнаружено влияние данного вещества на механические свойства поверхности клетки. Предполагается, что клеточные мембраны являются гибкими и изменчивыми; однако в определенных ситуациях (в частности, при химической обработке) трансформации происходят на биологическом и морфологическом уровнях. Такие наблюдения дают сильный повод для дальнейшего изучения морфологических изменений поверхности клетки как важнейшего требования для понимания клеточных функций относительно клеточной динамики. Методы сканирующей зондовой микроскопии, в частности АСМ и SICM, несомненно, являются крайне важными инструментами при проведении качественно-количественных исследований как зафиксированных, так и живых клеток.
Подробные характеристики
Мощного биологического исследовательского микроскопа Park NX-Bio
Ссылки
- Lanier, L. and N. Warner, Paraformaldehyde fixation of hematopoietic cells for quantitative flow cytometry (FACS) analysis. Journal of immunological methods,1981. 47(1): p. 25-30.
- Yamane, Y., et al., Quantitative analyses of topography and elasticity of living and fixed astrocytes. Journal of electron microscopy, 2000. 49(3): p. 463-471.
- Binnig, G., C.F. Quate, and C. Gerber, Atomic force microscope. Physical review letters, 1986. 56(9): p. 930.
- Korchev, Y.E., et al., Scanning ion conductance microscopy of living cells. Biophysical journal, 1997. 73(2): p. 653.
- Cappella, B. and G. Dietler, Force-distance curves by atomic force microscopy. Surface science reports, 1999. 34(1): p. 1-104.
- Mizutani, Y., et al., Nanoscale fluctuations on epithelial cell surfaces investigated by scanning ion conductance microscopy. Applied Physics Letters, 2013. 102(17): p. 173703.
- Rheinlaender, J., et al., Comparison of scanning ion conductance microscopy with atomic force microscopy for cell imaging. Langmuir, 2010. 27(2): p. 697-704.
- Hopwood D. Theoretical and practical aspects of glutaraldehyde fixation. InFixation in histochemistry, Springer, Boston, MA. 1973: p. 47-83.
- Tanaka KA, et al., Membrane molecules mobile even after chemical fixation. Nature Methods. 2010 Nov;7(11):865.