Автор: ГалинаРаздел: Анализ микроструктуры материалов
Автор: ГалинаРаздел: Анализ микроструктуры материалов
Автор: ГалинаРаздел: Спектроскопия
Автор: ГалинаРаздел: Анализ микроструктуры материалов
Автор: ГалинаРаздел: Анализ микроструктуры материалов
Автор: Раздел: Атомно-силовая микроскопия
Автор: ГалинаРаздел: Анализ микроструктуры материалов
Автор: ВикторРаздел: Атомно-силовая микроскопия
Автор: ВикторРаздел: Атомно-силовая микроскопия
Автор: ВикторРаздел: Атомно-силовая микроскопия
Нажимая кнопку «Подписаться», вы принимаете условия «Соглашения на обработку персональных данных».
Рамановская спектроскопия пропускания для онлайн мониторинга однородности состава фармацевтических препаратов
Введение
Анализ однородности состава (CU – определение однородности распределения активного вещества в дозированной единице) является важной задачей на любом фармацевтическом производстве, поскольку он дает гарантию, что конечный продукт, поступающий потребителю, содержит необходимую и безопасную дозу активного фармацевтического компонента/ингредиента (АФИ/API). Традиционно для решения данной задачи использовалась высокоэффективная жидкостная хроматография (HPLC), которая выполнялась удаленно в лаборатории по контролю качества для отслеживания дозы в конечном продукте, поскольку она отличается высокой чувствительностью и возможностью проведения измерений по всему объему таблетки. Однако анализ методом HPLC требует большого количества растворителей и других расходных материалов, а также зачастую на его выполнение уходит несколько часов. Как результат, данный медленный и разрушающий метод контроля требует высококвалифицированного персонала и может приводить к задержкам в производственном процессе.
Аналитические методы для контроля однородности состава в идеальном случае должны быть быстрыми, точными, неразрушающими и давать результаты при анализе небольшого количества образца с минимальной пробоподготовкой. Недавно, такие методы как ИК спектроскопия пропускания и рамановская спектроскопия пропускания были опробованы как альтернативные методы быстрого и неразрушающего контроля однородности состава в онлайн режиме на линии производства без предварительной подготовки образца к анализу. Несмотря на то, что ИК спектроскопия пропускания является быстрой и неразрушающей, она характеризуется слабой химической избирательностью и чувствительна к изменениям окружающей среды. Рамановская же спектроскопия пропускания, объединенная с хемометрическим моделированием, быстро становится значимым методом анализа CU благодаря высокой химической избирательности, что особенно полезно и важно при работе со сложными фармацевтическими препаратами, которые содержат несколько активных веществ.
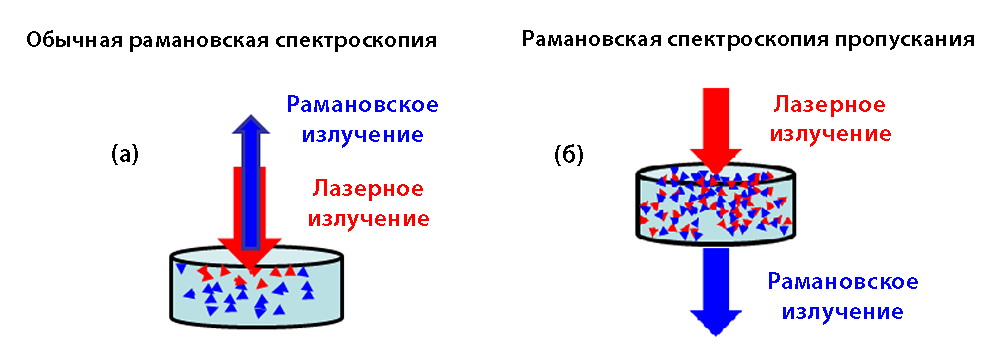
Обычная рамановская спектроскопия основана на сборе обратного рассеянного излучения, получаемого после облучения исследуемой поверхности лазерным излучением (см. рис. 1(а)). Несмотря на то, что данный метод является весьма удобным инструментом для идентификации и входного контроля качества исходных компонентов в условиях склада, он не предоставляет возможности проведения точного количественного анализа по всему объему таблетки, т.е. его помощью нельзя просканировать таблетку на достаточной глубине под верхними слоями оболочек и т.п. Рамановская же спектроскопия пропускания (TRS) способна преодолеть описанное ограничение и подходит для анализа однородности состава. При использовании TRS образец облучается с одной стороны, а полезный сигнал собирается с противоположной стороны (см. рис. 1(б)). Собранный сигнал несет в себе информацию о распределении активных компонентов по всему объему таблетки. Далее, при использовании хемометрических моделей, возможен точный количественный анализ однородности состава таблетки.
Рис. 1. Методы измерения с помощью обычной (а) и пропускающей (б) рамановской спектроскопии.
Компания B&W Tek представляет портативный рамановский спектрометр QTRam, выполненный по запатентованной технологии STRaman, который позволяет проводить быстрый и простой анализ CU фармацевтических препаратов методом TRS. В добавление к функционалу пропускания данный спектрометр также оснащен универсальным рабочим зондом, формирующим на выходе лазерное пятно большого диаметра, что предоставляет дополнительную возможность проведения анализа для контроля однородности смеси (BU – проверка однородности распределения активных компонентов в смеси перед началом процесса таблетирования) на любой из стадий производства (измельчение, смешивание и т.д.), помогая выявить несоответствие нормам и/или отработать весь процесс подготовки.
В данной статье демонстрируется проверка и степень пригодности метода TRS для анализа однородности состава на примере таблеток, содержащих ацетаминофен (парацетамол), маннитол, лактозу, целлюлозу и стеарат магния. Данные были получены с помощью рамановского спектрометра QTRam с дальнейшим анализом с помощью хемометрических моделей для количественной оценки ацетаминофена и лактозы, созданных с помощью программного обеспечения BWIQ. Полученные модели были валидированы на QTRam с помощью программы BWAnalyst (соответствует 21 CFR часть 11), установленной на планшете с сенсорным экраном, встроенном в прибор. Эта особенность позволяет создавать быстрые и точные модели для анализа.
Эксперимент
Исследуемые образцы
Было подготовлено пять различных групп смесей, содержащих в себе ацетаминофен, маннитол, лактозу, микрокристаллическую целлюлозу (МКЦ) и стеарат магния. Концентрация ацетаминофена в каждой из групп варьировалась в диапазоне 10 – 18%, а концентрация лактозы в диапазоне 10.79 – 28.66%. Из каждой смеси были сформированы круглые таблетки (с помощью таблетировочного пресса Гамлена) диаметром 6 мм и толщиной 4.5 мм. При формировании таблетки прикладывалось усилия в 392 кг. Каждая таблетка имела вес примерно 140 мг. Для каждой группы было изготовлено 10 таблеток. В таблице 1 приведены значения концентраций исходных компонентов для каждой группы.
Таблица 1. Концентрации исходных компонентов в подготовленных смесях (массовая доля, %)
| Группа | Ацетами- нофен |
Манни- тол |
Лактоза | МКЦ | Стеарат магния | Общее |
| 1 | 18 | 27.32 | 10.79 | 42.90 | 1.00 | 100 |
| 2 | 16 | 20.41 | 16.22 | 46.37 | 1.00 | 100 |
| 3 | 14 | 15.62 | 20.53 | 48.85 | 1.00 | 100 |
| 4 | 12 | 23.31 | 28.66 | 35.03 | 1.00 | 100 |
| 5 | 10 | 28.05 | 18.03 | 42.92 | 1.00 | 100 |
Измерения
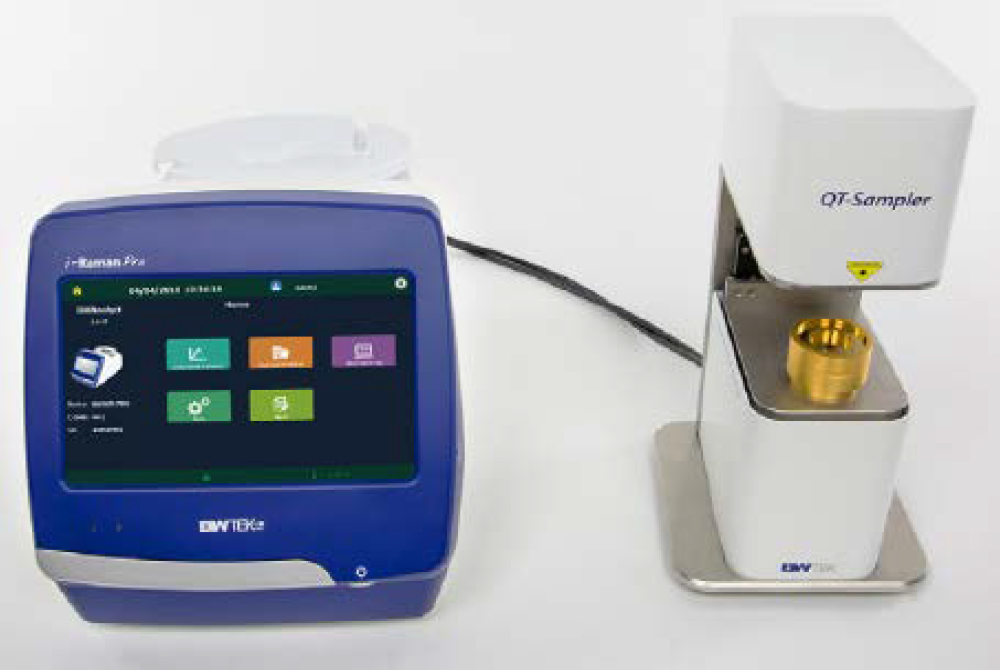
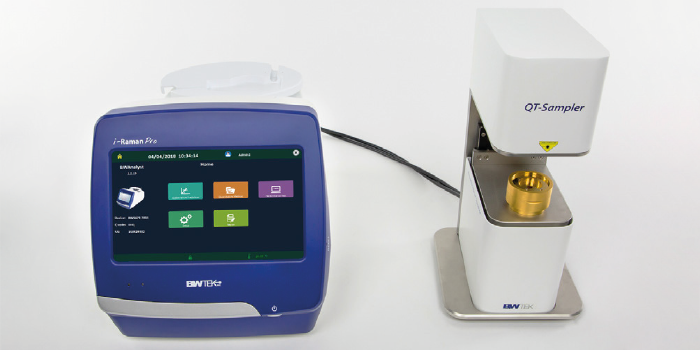
Для анализа каждой подготовленной таблетки использовался портативный рамановский спектрометр QTRam с измерительным аксессуаром QT-Sampler (см. рис. 2). В приборе используется лазер с длиной волны излучения 785 нм и максимальной выходной мощностью до 340 мВт (регулируется программно). Размер лазерного пятна, используемого во время измерений, составил 4 мм. При разработке и валидации методов анализа, а также при прогнозировании все измерения проводились при 100% выходной мощности лазера и времени сбора сигнала 20 секунд.
Измерения проводились с каждой из сторон таблетки для более точного получения информации о составе по всему объему таблетки. Полученные спектры экспортировались в BWIQ для создания моделей количественного расчета.
Рис. 2. Портативный рамановский спектрометр QTRam с измерительным аксессуаром QT-Sampler для проведения измерений методом TRS. Для анализа использовалось ПО BWAnalyst (показано на экране планшета, встроенного в прибор).
Результаты измерений
Создание метода
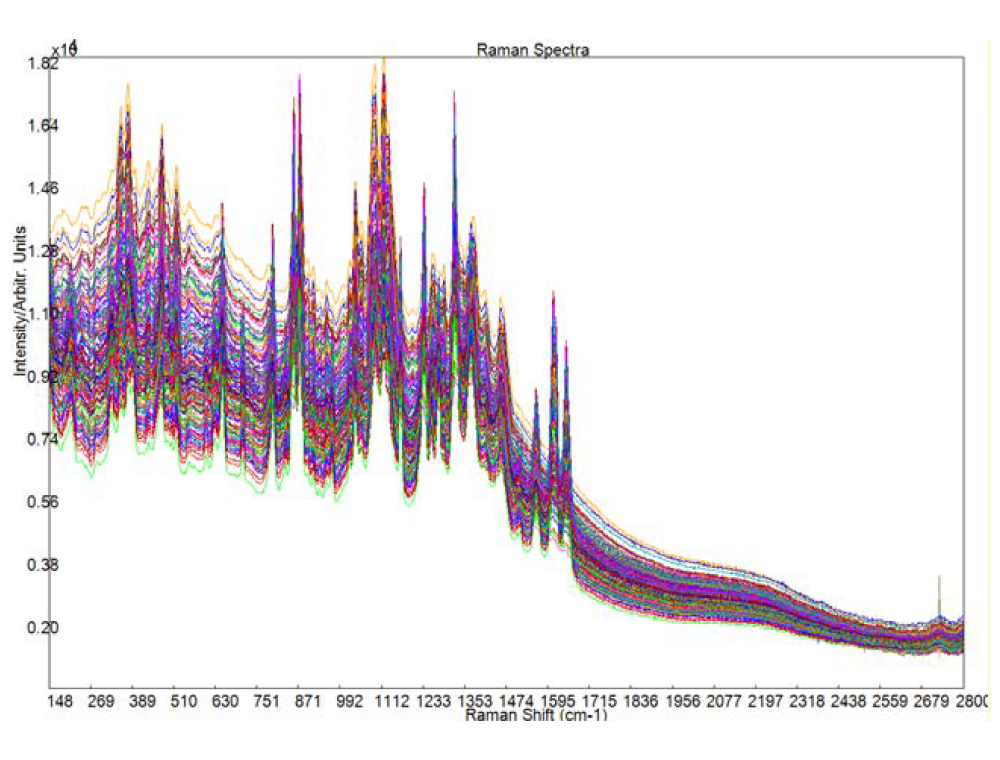
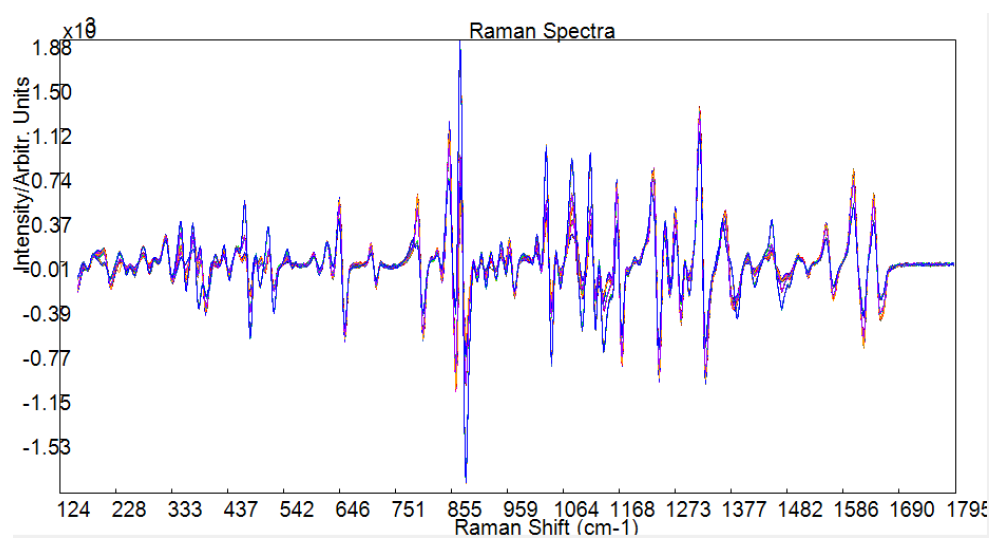
Для создания метода с помощью BWAnalyst использовалось 7 таблеток из каждой группы. Для каждого образца было собрано по три спектра – всего 105 спектров для метода. Спектры были экспортированы с прибора в программное обеспечение BWIQ для создания моделей количественного расчета для ацетаминофена и лактозы. На рис. 3 показаны все 105 полученных спектров, экспортированных в BWIQ. Из-за небольших отличий по массовой доле между компонентами уровень фонового сигнала варьируется для каждого спектра.
Рис. 3. Все 105 спектров, полученных на QTRam и экспортированных в BWIQ.
Для сортировки спектров на калибровочные и проверочные был использован алгоритм случайного отбора. 70% исходных данных были случайно определены как калибровочные спектры, остальные 30% были определены как проверочные спектры. Статистических выбросов (несоответствий) не было обнаружено после проведения соответствующего анализа.
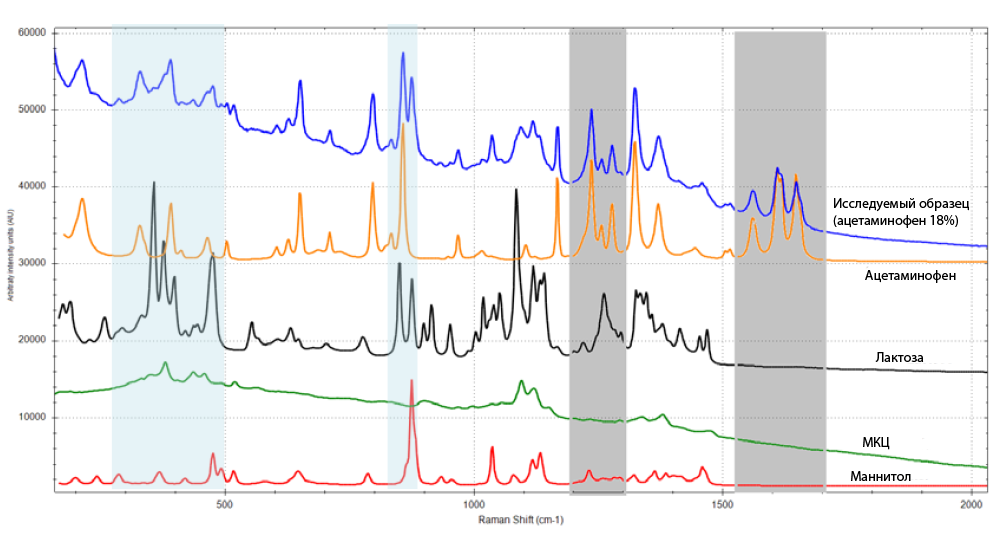
На рис. 4 представлено сравнение спектра таблетки, содержащей 18% ацетаминофена и 10.79% лактозы со спектрами основных чистых исходных компонентов. Спектральные области, соответствующие характерному сигналу от ацетаминофена и лактозы были выбраны для дальнейшего хемометрического моделирования (выделены серым и голубым соответственно). Области волновых чисел 1190 – 1300 см-1 и 1530 – 1700 см-1 были выбраны для моделирования ацетаминофена, поскольку характерные пики в данных областях полностью соответствуют характерным пикам чистого ацетаминофена. Области волновых чисел 285 – 500 см-1 и 840 – 890 см-1 были выбраны для моделирования лактозы, поскольку характерные пики в данных областях также полностью соответствуют характерным пикам чистой лактозы. Каждый из полученных 105 спектров обладает характерными пиками в указанных областях.
Рис. 4. Сравнение рамановского спектра пропускания одной из анализируемых таблеток со спектрами пропускания чистых исходных компонентов. Голубая область анализа соответствует области моделирования лактозы; серая область анализа соответствует области моделирования ацетаминофена.
Построение хемометрической модели
Для снижения влияния смещения базовой линии и темновых шумов на создаваемую модель было выполнено несколько шагов предварительной обработки: метод вычитания air-PLS для удаления шумовой составляющей и метод коррекции MSC для коррекции базовой линии. Дополнительно к полученным спектрам была применена первая производная (тип Савицки-голая, размер окна 11, порядок 3). Данные были смоделированы методом регрессии частичных наименьших квадратов (PLS). На рис. 5 показан вид спектров после предварительной обработки.
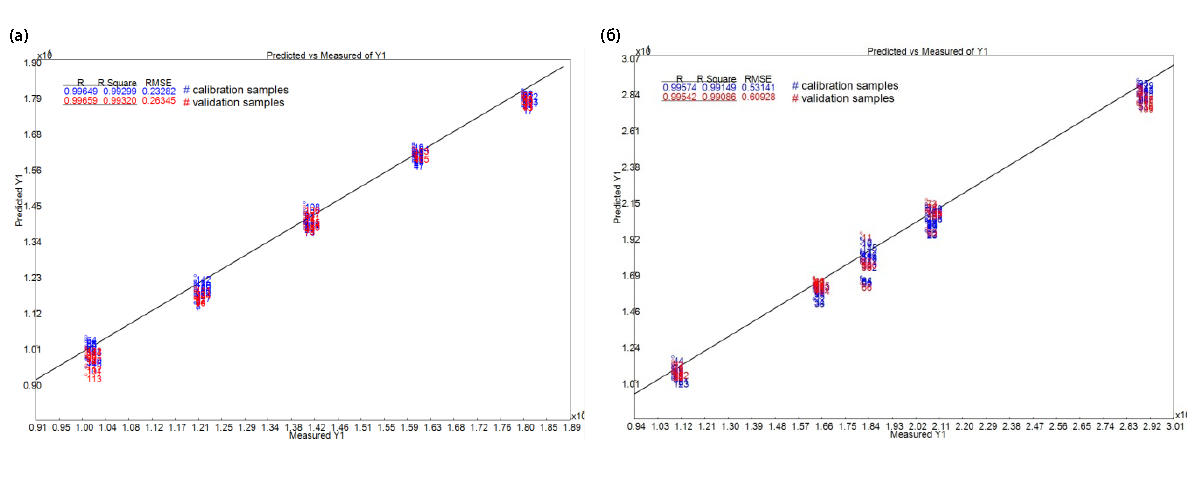
На рис. 6 представлены графики зависимости прогнозируемых значений от измеренных значений, полученные для калибровочных и проверочных образцов ацетаминофена и лактозы по PLS моделям. В модели анализа ацетаминофена использовалось вычисление по четырем принципиальным компонентам; в модели анализа лактозы использовалось вычисление по пяти принципиальным компонентам. Коэффициент R2 показывает насколько близко полученные данные стоят к линии регрессии. Значения R2 для моделей калибровочных спектров ацетаминофена и лактозы составляют 0.9929 и 0.99149 соответственно. Среднеквадратичная ошибка (RMSE) данных моделей составляет 0.23282 для ацетаминофена и 0.53141 для лактозы.
Рис. 5. Вид полученных спектров после и х предварительной обработки в BWIQ.
Рис. 6. Графики зависимости прогнозируемых значений от измеренных значений, полученные для калибровочных и проверочных образцов ацетаминофена (слева) и лактозы (справа) по PLS моделям.
Валидация метода
Модели, полученные в BWIQ, были импортированы обратно в BWAnalyst. Был построен метод, содержащий модели для ацетаминофена и лактозы. Для каждой модели метода были даны верхний и нижний пределы для простой идентификации на соответствие (Pass/Годен) или несоответствие (Fail/Негоден). Для ацетаминофена нижний предел составил 10%, верхний – 14%; для лактозы нижний предел составил 18%, верхний – 30%. Далее отдельные наборы проверочных спектров (образцы, не включенные в калибровочную модель) были получены на QTRam. Из каждой группы было взято по две таблетки и снято по три спектра для каждого образца. Результаты прогнозирования проверочных образцов представлены в таблице 2 для модели ацетаминофена и в таблице 3 для модели лактозы.
Таблица 2. Результаты валидации PLS модели ацетаминофена.
| Группа | Истинная концентрация ацетаминофена (%) | Прогнозируемая концентрация ацетаминофена проверочных образцов (усреднение n=3) | Стандартное отклонение (n=3) (массовая доля, %) |
| 1 | 18 | 17.61 | 0.13 |
| 17.66 | 0.06 | ||
| 2 | 16 | 15.67 | 0.14 |
| 15.74 | 0.11 | ||
| 3 | 14 | 14.31 | 0.08 |
| 14.37 | 0.17 | ||
| 4 | 12 | 11.90 | 0.06 |
| 11.89 | 0.02 | ||
| 5 | 10 | 9.95 | 0.16 |
| 9.88 | 0.08 |
Таблица 3. Результаты валидации PLS модели лактозы.
| Группа | Истинная концентрация лактозы (%) | Прогнозируемая концентрация лактозы проверочных образцов (усреднение n=3) | Стандартное отклонение (n=3) (массовая доля, %) |
| 1 | 10.79 | 10.64 | 0.20 |
| 10.83 | 0.20 | ||
| 2 | 16.22 | 15.49 | 0.22 |
| 16.06 | 0.13 | ||
| 3 | 20.53 | 20.44 | 0.19 |
| 20.36 | 0.26 | ||
| 4 | 28.66 | 28.34 | 0.17 |
| 27.88 | 0.36 | ||
| 5 | 18.03 | 17.63 | 0.33 |
| 18.66 | 0.35 |
Выполняя функцию валидации метода в программе BWAnalyst, генерируются параметры производительности метода и включаются в отчет проверки метода. Таблица 4 обобщает параметры метода.
Таблица 4. Характеристики метода, полученные из процедуры валидации метода.
| Метод | Допустимый интервал | Линейность | Точность (массовая доля, %) |
| Ацетаминофен | 10 – 14 | 0.9889 | 0.2883 |
| Лактоза | 18 – 30 | 0.9923 | 0.5040 |
Прогнозирование
Далее метод был утвержден и выпущен в программе BWAnalyst. Это позволяет пользователем с уровнем учетной записи «Оператор» загружать данный метод для прогнозирования и определять концентрации новых образцов. Если для любого из анализируемых компонентов вычисленное значение будет находиться за границей допустимого интервала по концентрации (ниже нижнего предела или выше верхнего предела), то программа выдаст результат в виде «Fail/Негоден» (см. рис. 7(а)). Если оба анализируемых компонента находятся в допустимом интервале, то программа выдаст результат в виде «Pass/Годен» (см. рис. 7(б)).
И каждой группы была взята одна таблетка в качестве независимого контролируемого образца с целью проверки правильности прогнозирования содержания ацетаминофена и лактозы по созданным моделям. Для каждого образа было получено три спектра. Результаты прогнозирования для каждой таблетки представлены в таблице 5. Таблетка из группы 4 является единственным образцом, который удовлетворяет критериям идентификации на соответствие по заданной точности, установленным в программе BWAnalyst.
Таблица 5. Результаты определения концентрации ацетаминофена и лактозы по созданному методу.
| Группа | Истинная концентрация ацетаминофена (%) | Прогнозируемая концентрация ацетаминофена проверочных образцов (усреднение n=3) | Стандартное отклонение (n=3) (массовая доля, %) | Истинная концентрация лактозы (%) | Прогнозируемая концентрация лактозы проверочных образцов (усреднение n=3) | Стандартное отклонение (n=3) (массовая доля, %) | Результат анализа |
| 1 | 18 | 17.60 | 0.17 | 10.79 | 11.41 | 1.67 | Fail |
| 2 | 16 | 16.11 | 0.17 | 16.22 | 15.43 | 0.07 | Fail |
| 3 | 14 | 14.39 | 0.03 | 20.53 | 20.71 | 0.40 | Fail |
| 4 | 12 | 11.95 | 0.24 | 28.66 | 28.09 | 0.16 | Pass |
| 5 | 10 | 9.94 | 0.03 | 18.03 | 18.41 | 0.25 | Fail |
Рис. 7. Окно отображения результатов прогнозирования в программе BWAnalyst: ацетаминофен находится за границей допустимого интервала по концентрации – результат «Fail» (слева); ацетаминофен находится в пределах допустимого интервала по концентрации – результат «Pass» (справа).
Заключение
Данное исследование продемонстрировало, что метод рамановской спектроскопии пропускания является эффективным инструментом для быстрого контроля однородности состава непосредственно на линии производства в онлайн режиме. Было показано, что при анализе группового массива таблеток с изменяющимися концентрациями контролируемых компонентов, портативный спектрометр QTRam компании B&W Tek при совместном использовании с программами BWAnalyst (управление прибором, создание и валидация метода) и BWIQ (хемометрическое ПО для построения количественных моделей) способен строить метод, который в дальнейшем можно использовать для количественной оценки ацетаминофена и лактозы в готовой таблетке. Как альтернативный метод анализа однородности состава, рамановская спектроскопия пропускания – это простой и неразрушающий метод проверки, не требующий дополнительного использования растворителей и других расходных материалов.
Подробные характеристики портативного рамановского спектрометра QTRam