Автор: ГалинаРаздел: Анализ микроструктуры материалов
Автор: ГалинаРаздел: Анализ микроструктуры материалов
Автор: ГалинаРаздел: Спектроскопия
Автор: ГалинаРаздел: Анализ микроструктуры материалов
Автор: ГалинаРаздел: Анализ микроструктуры материалов
Автор: Раздел: Атомно-силовая микроскопия
Автор: ГалинаРаздел: Анализ микроструктуры материалов
Автор: ВикторРаздел: Атомно-силовая микроскопия
Автор: ВикторРаздел: Атомно-силовая микроскопия
Автор: ВикторРаздел: Атомно-силовая микроскопия
Нажимая кнопку «Подписаться», вы принимаете условия «Соглашения на обработку персональных данных».
Анализ плазмида в жидкости бесконтактным методом с помощью атомно-силовой микроскопии
Дезоксирибонуклеиновая кислота (ДНК) является одним из самых значимых открытий последнего века, в первую очередь из-за того, что она произвела революцию во многих областях, включая генетику, молекулярную биологию, медицинские исследования, сельское хозяйство, судебную медицину, и многие другие. ДНК представляет собой биологическую молекулу, которая обеспечивает хранение генетической информации, необходимой для функционирования организма, роста и репродукции всех живых организмов. Данная информация находится в ядре каждой клетки в организме и может передаваться не только от одной клетки к другой, но и от родителей к потомству. Следовательно, знание о структуре ДНК очень важно для понимания того, как происходит передача генетической информации.
Для изучения структуры ДНК были использованы несколько методик, одной из которой является электронная микроскопия (ЭМ). Однако из-за трудоемких требований к подготовке образца возникло несколько сложностей с его сохранением. В результате для преодоления этих сложностей была разработана атомно-силовая микроскопия (АСМ). Возможность с помощью атомно-силовой микроскопии получать изображения в жидкости позволяет сохранять состояние биологического образца и обеспечивает более высокое качество изображений с высоким разрешением [1]. Бесконтактный режим измерения True Non-Contact компании Park Systems позволяет проводить измерение топографии образца без необходимости взаимодействия между сканирующим зондом и образцом, которое может привести к повреждению поверхности образца и износу кантилевера. Таким образом, данный режим является более предпочтительным при измерении образца, который чувствителен к деформации поверхности, чем контактный или полуконтактные режимы. Улучшенная конструкция Z-сканера атомно-силовых микроскопов компании Park Systems является ключевой особенностью для достижения необходимой производительности бесконтактного режима сканирования. Именно режим Tru Non-Contact позволяет получать высокое сканирующее разрешение и наиболее точные топографические данные, одновременно сохраняя остроту кантилевера и снижая вероятность повреждения поверхности образца [2].
Эксперимент
В ходе исследования на подложке из слюды было диспергировано 45 нг образца плазмида (кольцевая разновидность молекулы ДНК), которые затем были просканировано с помощью атомно-силового микроскопа NX10 компании Park Systems в жидкости в режиме True Non-Contact. В данном эксперименте использовали кантилевер с относительно низкой номинальной резонансной частотой 110 кГц и коэффициентом жесткости 0.09 Н/м.
Изображение было получено в бесконтактном режиме путем регистрации изменений амплитуды колебаний кантилевера, вызванных силами межатомного взаимодействия (силы Ван-дер-Ваальса), так как кантилевер во время сканирования механически колеблется вблизи своей резонансной частоты. Регистрируемые изменения в амплитуде компенсировались за счет механизма обратной связи таким образом, что заданная амплитуда и расстояние кантилевер-образец поддерживались постоянными. Т.е. в бесконтактном режиме топография поверхности образца измеряется с помощью контроля движения Z-сканера через обратную связь [2]. В жидкости резонансная частота кантилевера уменьшается на треть величины от его исходного значения в воздухе за счет демпфирующих эффектов; аналогичное уменьшение наблюдается и в его амплитуде. Кроме того, многочисленные пики можно наблюдать по частотной развертке в жидкости – в воздухе наблюдается меньше флуктуаций.
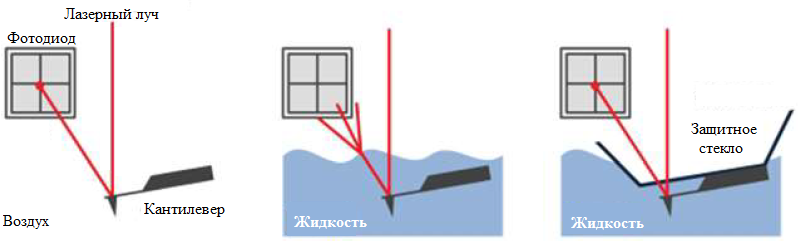
Таким образом, перед началом измерения была выбрана соответствующая резонансная частота путем выбора самого высокого пика рядом в областью порядка 1/3 части от исходной резонансной частоты, а амплитуда колебаний была установлена на значение 0.9 нм. Механизм обратно связи АСМ использует излучение лазерного диода, луч которого отражается от кантилевера. Однако, из-за нестабильности поверхности жидкости во время измерения, отражаемый луч будет рассеиваться. По этой причине компания Park Systems спроектировала уникальный держатель зонда с защитным стеклом для решения данной проблемы.
Рис. 1. Принцип работы механизма обратной связи режима True Non-Contact при сканировании в воздухе и в жидкости. Закрытый держатель зонда со стеклом показывает его удобство для поддержания оптимальных условий измерения.
Результаты и выводы
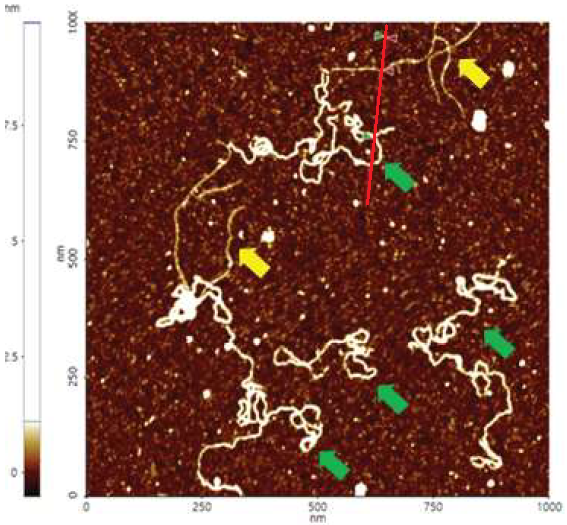
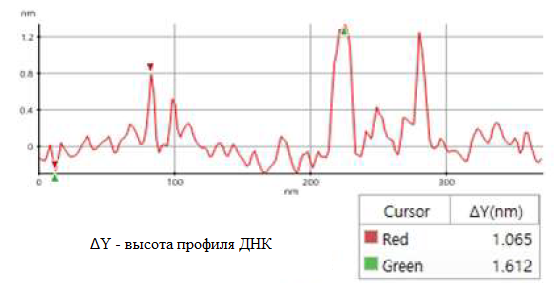
Качественное изображение с высоким разрешением было успешно получено для образца плазмида и обработано с помощью программного обеспечения XEI, разработанного Park Systems. Предполагалось, что образец состоит из однородных линейных плазмид. Однако, топографические данные на рис. 2 показывают, что область сканирования в 1х1 мкм содержит набор смешанных цепей ДНК линейных и сверхспиральных плазмид. Цепи с более крупными структурами отмечены зелеными стрелками – они демонстрируют сверхспиральное образование с диаметром около 19 нм, а цепи с меньшими линейными структурами отмечены желтыми стрелками и, как, оказалось, находятся в ненапряженном состоянии с диаметром около 8 нм. Также было отмечено, что сверхспиральные цепи ДНК оказались длиннее при сравнении с линейными цепями. Профиль поперечного сечения, построенный в XEI (см. рис. 3), дает информацию о высоте цепей ДНК. Данные показывают, что сверхспиральные цепи имеют высоту 1.6 нм, а высота линейной цепи составляет только 1 нм.
В своей нормальной окружающей среде (ядро клетки) ДНК сама закручивается для преодоления деформации, так как она подвергается напряжению кручения во время репликации. Подобное явление могло произойти и в линейной ДНК в ходе этого эксперимента. Предполагается, что линейная молекула ДНК становится сверхспиральной из-за напряжения кручения во время подготовки образца к анализу. Конец плазмида возможно прилипал к подложке сильнее, чем ожидалось, и, так как ДНК подвергается напряжению кручения, то ДНК закручивается и скомкивается, что приводит к появлению большей и сверхспиральной структуры с увеличенными порядками скручивания [3].
Рис. 2. Топографическое изображение плазмид, полученное в бесконтактном режиме: области, выделенные желтыми стрелками, имеют линейные структуры; области, выделенные зелеными стрелками, имеют сверхспиральные структуры. Размер изображения: 1 х 1 мкм.
Рис. 3. Профиль поперечного сечения плазмида, полученный при анализе вдоль красной линии (см. рис. 2). Красный маркер: более мелкие, линейные ДНК-структуры; зеленый маркер: более крупные, сверхспиральные ДНК-структуры.
Заключение
Структура образца плазмида была успешно охарактеризована с помощью атомно-силового микроскопа NX10 компании Park Systems с использованием бесконтактного метода сканирования в жидкости в режиме True Non-Contact. Топографические данные показали, что образец характеризуется наличием ДНК с двумя различными супер-структурами: линейной конфигурацией и сверхспиральной, которая, как предполагается, возникла из-за напряжения кручения во время подготовки образца. Выявлено, что одна линейная плазмида имеет ширину 8 нм и высоту 1 нм. Для сравнения, одна сверхспиральная плазмида имеет ширину 19 нм и высоту 1.6 нм. Таким образом, методика, описанная в данной работе, предоставляет исследователям данные на уровне наномасштабов, которая имеет важное значение при контроле структурных повреждений и конформационных изменений в ДНК.
Подробные характеристики атомно-силового микроскопа Park NX10
Ссылки
- A. Baro, et al., Atomic Force Microscopy in Liquid: Biological Applications. Wiley-VCH, Pages 233-237.
- J. Pineda, et al., True Non-Contact Imaging of Various Samples, Retrieved January 12, 2017, from http://www.parkafm.com/index.php/medias/nano-academy/articles
- H. Hansma, et al., Reproducible Imaging and Dissection of Plasmid DNA Under Liquid with the Atomic Force Microscope, AAAS, Pages 1180-1181.