Автор: ГалинаРаздел: Анализ микроструктуры материалов
Автор: ГалинаРаздел: Анализ микроструктуры материалов
Автор: ГалинаРаздел: Спектроскопия
Автор: ГалинаРаздел: Анализ микроструктуры материалов
Автор: ГалинаРаздел: Анализ микроструктуры материалов
Автор: Раздел: Атомно-силовая микроскопия
Автор: ГалинаРаздел: Анализ микроструктуры материалов
Автор: ВикторРаздел: Атомно-силовая микроскопия
Автор: ВикторРаздел: Атомно-силовая микроскопия
Автор: ВикторРаздел: Атомно-силовая микроскопия
Нажимая кнопку «Подписаться», вы принимаете условия «Соглашения на обработку персональных данных».
Идентификация микропластиков с помощью рамановской микроскопии

За последние несколько десятилетий пластиковый мусор превратился в вызывающую обеспокоенность проблему, приводящую к загрязнению мирового океана. Микропластик, определяемый как пластиковый мусор размером менее 5 мм, считается наиболее распространенной формой морского мусора [1, 2]. К микропластику относятся как небольшие промышленные изделия, такие как волокна и бусинки (первичный микропластик), так и предметы, полученные в результате фрагментации из более крупных пластиковых предметов в результате сочетания физических, химических и биологических процессов и включает фрагменты, пленки и пенопласты (вторичный микропластик).
Пластиковый морской мусор обычно берет свои начала от наземных отходов и впоследствии попадает в устья рек и прибрежные районы океана [3]. После попадания в морскую среду микропластик распространяется по воде с помощью приливов, турбулентных потоков воды и океанских течений, рассеивая его по океанам и по всей водной толще [4]. Богатые экосистемы и высокая биологическая продуктивность прибрежных сред предполагают более частое биологическое взаимодействие с микропластиками в прибрежных районах, чем в открытом океане [5]. И хотя вероятность накопления пластика выше в прибрежных и водах эстуария, очень мало исследований сосредоточили свое внимание на микропластике именно в этих регионах [6].
С ростом исследований микропластиков в последние годы стало критически важным расширить возможности исследовательских лабораторий по регулярному анализу химического состава микропластиков из проб окружающей среды. Часто визуальный осмотр изначально используется для выделения микропластика из образцов, собранных в полевых условиях, но это может привести к неправильной классификации микропластика, а также к случайному исключению пластиковых деталей. Спектроскопические методы имеют решающее значение, поскольку они могут подтвердить ручное выявление микропластика посредством идентификации полимеров. Такие подходы могут помочь в определении места происхождения материала и могут выявить добавки, которые сами по себе могут оказывать негативное биологическое воздействие.
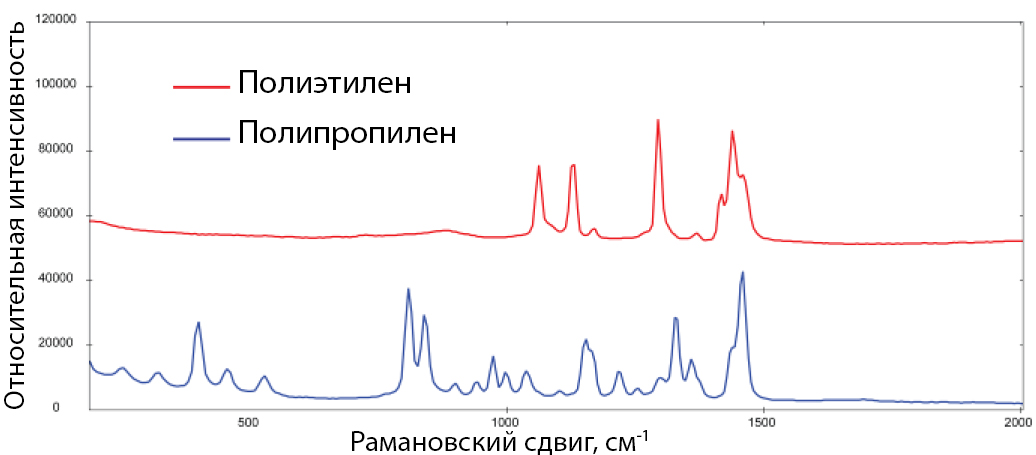
Обычно полимеры и, соответственно, пластики генерируют сильный рамановский сигнал. На рисунке 1 показаны спектры комбинационного рассеяния полиэтиленовых и полипропиленовых материалов, измеренные при возбуждении на длине волны 1064 нм.
Пластики можно четко различить по их спектральным характеристикам. Эталонная библиотека также может быть создана для легкой идентификации неизвестного микропластического материала (также доступны коммерческие библиотеки). Хотя инфракрасная спектроскопия с преобразованием Фурье (FTIR) – это еще один метод, который часто используется для идентификации микропластиков, комбинационный анализ предлагает более простой отбор проб малых (< 100 мкм) частиц, чем для FTIR. Рамановские спектрометры также более портативные, по сравнению с системами для FTIR, поэтому анализ можно проводить на месте подготовки проб.
В этой статье мы рассмотрим использование портативной рамановской микроскопии для идентификации микропластика, извлеченного из поверхностных вод эстуария.
Рис. 1. Типовые рамановские спектры полиэтилена и полипропилена.
Эксперимент
Образцы воды были собраны из поверхностных вод залива Делавэр (США) путем проведения 5-минутных буксировок с использованием кольцевой планктонной сети (диаметр 1 м, сетка из нитекса 200 мкм), снабженной расходомером [7]. Затем образцы переносили в стеклянные сосуды и фиксировали 4%-ым формальдегидом. Общий образец фракционировали по размеру на ситах из нержавеющей стали (5000, 1000 и 300 мкм). После сушки образцов в течение ночи при 90°C для отделения микропластика от расщепленного органического материала в двух фракционированных образцах меньшего размера использовали процессы влажного окисления пероксида и разделения по плотности [8]. Затем микропластики собирали на сетку из нитекса 200 мкм и складывали в алюминиевую фольгу для сушки.
Микропластики из этих образцов были подсчитаны путем ручного исследования под стереомикроскопом в вытяжном шкафу с ламинарным потоком, и каждой детали был присвоен тип пластика (т.е. фрагмент, волокно, шарик, пленка, пенопласт, резина). За подсчетом и разделением по категориям следовала идентификация пластика с использованием рамановской спектроскопии.
Для всех измерений использовалась портативная рамановская система i-Raman EX с лазерным возбуждением на длине волны 1064 нм (краткие тех. характеристики см. в таблице 1). Лазерное возбуждение с длиной волны 1064 нм требуется для ослабления флуоресценции, которая обычно возникает при анализе окрашенных образцов микропластиков при возбуждении с помощью лазера с длиной волны 785 нм. Портативный видеомикроскоп с объективом с 50-кратным увеличением (рабочее расстояние 9.15 мм, размер пятна лазера на образце 42 мкм) использовался для визуализации микропластиков.
Для сбора данных использовалось программное обеспечение BWSpec. Время сбора сигнала составляло от 30 с до 3 минут, а мощность лазера поддерживалась ниже 50% от максимальной мощности лазера (< 165 мВт), чтобы избежать горения образца. Спектры были скорректированы по интенсивности в соответствии со стандартом коррекции интенсивности комбинационного рассеяния NIST 2244, но в остальном никакая другая предварительная обработка спектров не применялась. Программное обеспечение BWID использовалось для идентификации микропластиков по эталонной библиотеке спектров пластиковых материалов.
Таблица 1. Краткие технические характеристики спектрометра i-Raman EX.
| Длина волны лазера | 1064 нм |
| Максимальная выходная мощность | 330 мВт |
| Спектральный рабочий диапазон | 100 – 2500 см-1 |
| Тип детектора | InGaAs с TE охлаждением до -15°C |
Результаты
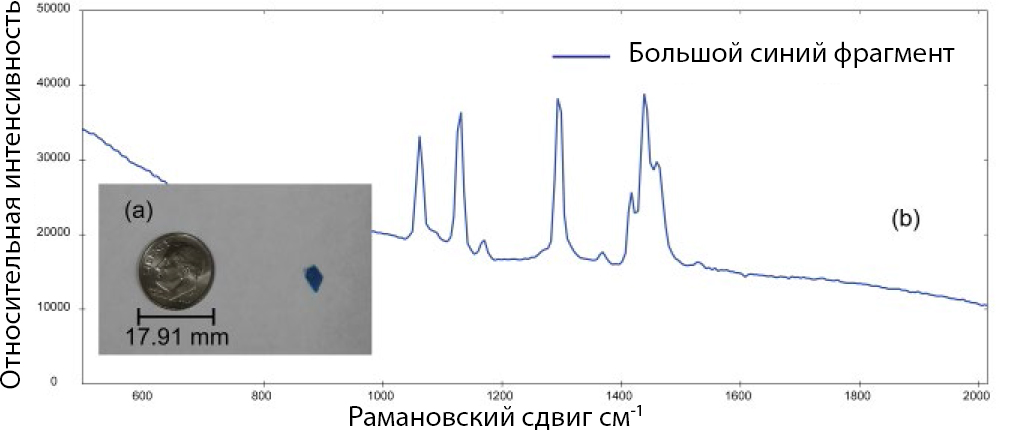
Несколько образцов микропластиков различных типов и размеров были проанализированы с использованием i-Raman EX. На рис. 2а представлена фотография большого синего фрагмента микропластика. Диаметр этого фрагмента составляет ≈4.5 мм, что является верхним пределом диапазона размеров частицы, которую можно назвать микропластиком. Из-за неправильной формы частицы образец, вероятно, является вторичным микропластиком. На рис. 2б показан спектр комбинационного рассеяния, полученный для синего фрагмента.
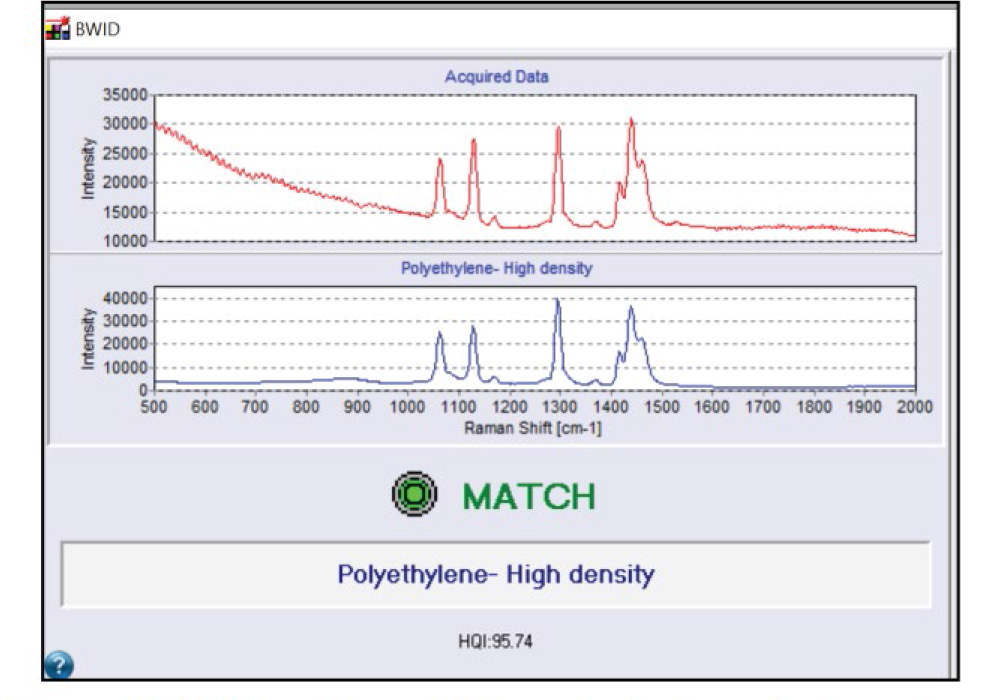
Программное обеспечение BWID сравнивает полученный спектр неизвестного образца с эталонной библиотекой материалов, используя рассчитанный индекс качества соответствия (HQI). HQI – это коэффициент корреляции, который измеряет, насколько спектр исследуемого образца похож на эталонный спектр. Результаты поиска в спектральной библиотеке ранжируются от HQI, равного 100 (лучшее совпадение), до HQI, равного 0 (худшее совпадение).
Для расчета к спектрам применяется первая производная. Существует множество спектральных библиотек, доступных для использования с BWID, и программное обеспечение также поддерживает создание пользовательских библиотек. BWID сопоставило синий фрагмент на рис. 2а с эталонным спектром полиэтилена (PE) с расчетным HQI 95.7 (рис. 3), что указывает на сильное совпадение.
Рис. 2. Анализируемый объект (а; монета 10 центов для масштаба) и его рамановский спектр (б).
Рис. 3. Результат анализа «Match» («Совпадение») для полиэтилена. Красный спектр – спектр образца, представленного на рис. 2а; Синий спектр – эталонный спектр полиэтилена из библиотеки.
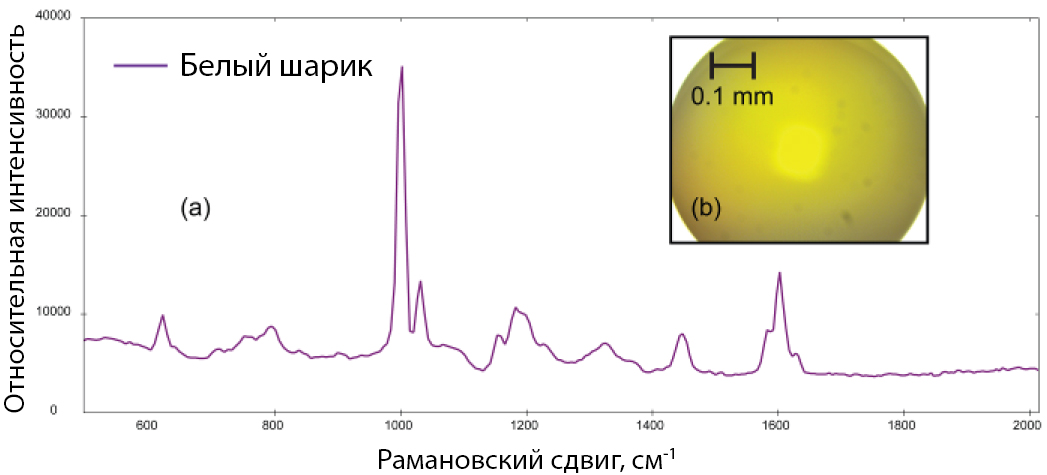
Также были идентифицированы другие пластмассовые материалы, такие как полистирол (PS) и полипропилен (PP). На рис. 4а показан спектр комбинационного рассеяния света, полученный от небольшого сферического шарика (микрофотография показана на рис. 4б). Этот шарик, вероятно, является первичным микропластиком. BWID сопоставило спектр с эталонным спектром полистирола с HQI 98.2.
Рис. 4. Рамановский спектр полистирола (а), полученный от шарика (б; цветопередача искажена).
Волокна – важная подгруппа микропластических частиц. Они могут выделяться из синтетической одежды и другого пластикового текстиля в процессе производства, а также через сточные воды. Синтетические рыболовные лески также являются основным источником загрязнения микрофиброй.
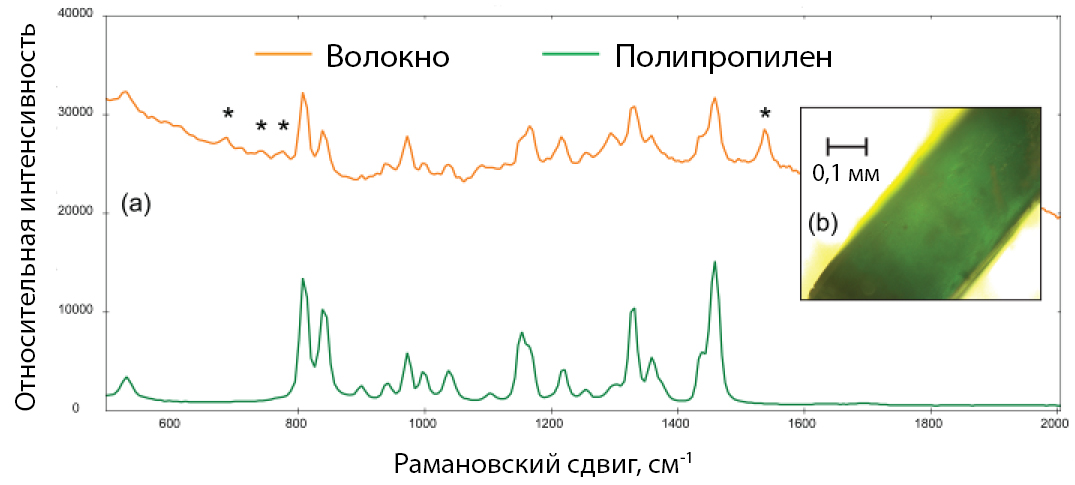
На рис. 5а показан спектр комбинационного рассеяния света, полученный от тонкого бирюзового волокна (микрофотография показана на рис. 5б). BWID сопоставляет спектр комбинационного рассеяния образца с эталонным спектром полипропилена с расчетным HQI 74.9. Хотя это значение может показаться низким, при дальнейшем наблюдении в спектре образца появляются некоторые дополнительные пики, которые нельзя отнести к полипропилену.
При дальнейшем исследовании пик вблизи 1537 см-1 и набор слабых пиков в районе 670-790 см-1 в спектре образца согласуются со спектром комбинационного рассеяния зеленого пигмента на основе фталоцианина хлорированной меди [9]. И хотя краситель, используемый в пластике обычно не является решающим вопросом исследования, это полезная информация для определения происхождения образца.
Рис. 5. (а) Рамановский спектр зеленоватого волокна (оранжевый), сравниваемый со спектром полипропилена (зеленый); (б) микрофотография исследуемого волокна. (*) – отмеченные пики, соотнесенные с наличием зеленого красителя в волокне.
В таблице 2 приведены сводные данные проведенного анализа спектров комбинационного рассеяния микропластика. Все материалы были идентифицированы как полиэтилен, полипропилен или полистирол. Несколько образцов дали неубедительные результаты: большинство этих образцов представляют собой черные микропластические образцы, которые поглощают как возбуждающее, так и рассеянное излучение, что очень затрудняет их идентификацию с помощью рамановской спектроскопии.
Еще одно наблюдаемое ограничение – хрупкость микроволокон. Мощность лазера, подаваемая на волокна, должна быть низкой (≈ 10% от максимальной мощности лазера), поскольку более высокая мощность лазера может вызвать искажение и горение образца.
Таблица 2. Суммарные данные результатов анализа в BWID.
| Результат совпадения | Количество выявленных совпадений |
| Полиэтилен | 11 |
| Полипропилен | 4 |
| Полистирол | 2 |
| Неубедительный результат | 5 |
Заключение
Поскольку присутствие микропластиков в морской среде представляет собой надвигающуюся угрозу для нашей окружающей среды, их надежный анализ будет важной темой исследований на долгие годы. Рамановская микроскопия – это эффективный инструмент для однозначной идентификации таких микропластиков. Использование возбуждения в ближнем инфракрасном диапазоне важно для уменьшения флуоресценции красителей, используемых в пластиках, а программные алгоритмы корреляции полезны для их простой идентификации.
Авторы
- Jonathan H. Cohen*, University of Delaware School of Marine Science and Policy
- Taylor Hoffman*, University of Delaware School of Marine Science and Policy
- Kristen Frano, B&W Tek
*Частично поддерживается за счет грантов по программе Delaware Sea Grant College.
Подробные характеристики рамановской системы с длиной волны возбуждения 1064 нм i-Raman EX
Ссылки
- K.L. Law, Annu. Rev. Mar. Sci. 9, 205-229 (2017)
- T.S. Galloway, M. Cole and C. Lewis, Nat. Ecol. Evol. 1 (2017)
- J. R. Jambeck, R. Geyer, C. Wilcox, T. R Siegler, M. Perryman, A. Andrady, R. Narayan, and K. L. Law, Science. 347, 768-771 (2015)
- R. C. Hale, M.E. Seeley, M.J. La Guardia, L. Mai and E.Y. Zeng, J. Geophys. Res. Oceans. 125 (2020)
- J. R. Clark, M. Cole, P. K. Lindeque, E. Fileman, J. Blackford, C. Lewis, T. M. Lenton, and T. S. Galloway, Front. Ecol. Environ. 14, 317-324 (2016)
- P. Vermeiren, C.C. Muñoz, and K. Ikejima, Mar. Pollut. Bull. 113, 7-16 (2016)
- J.H. Cohen, A.M. Internicola, R.A. Mason, and T. Kukulka, Environ. Sci. Technol. 53, 14204−14211 (2019)
- J. Masura, J. Baker, G. Foster, and C. Arthur, “Laboratory Methods for the Analysis of Microplastics in the Marine Environment: Recommendations for Quantifying Synthetic Particles” in Waters and Sediments; NOAA Technical Memorandum NOS-OR&R-48, National Oceanic and Atmospheric Administration: Washington, DC, 2015
- A. Duran, M. L. Franquelo, M. A. Centeno, T. Espejoc, and J. L. Perez-Rodrigueza, J. Raman Spectrosc. 42, 48–55 (2011)


 Подробные характеристики рамановской системы с длиной волны возбуждения 1064 нм i-Raman EX
Подробные характеристики рамановской системы с длиной волны возбуждения 1064 нм i-Raman EX